Широкое применение антибиотиков основано на предположении, что, кроме токсичности при использовании в больших дозах, антибиотики нарушают биологические процессы в микроорганизмах, но не в организме хозяина.
Однако недавние исследования на безмикробных животных начинают обнаруживать нераспознанные эффекты, которые антибиотики оказывают на хозяина. Растущее воздействие антибиотиков в последнее время связано с многочисленными заболеваниями, которые сегодня широко распространены в промышленно развитых странах. Например, взаимодействие между диетой и изменениями микробиоты кишечника, вызванными антибиотиками, ассоциируется с ожирением и диабетом. Еще одна группа заболеваний, распространенность которых растет в промышленно развитых странах, - это воспалительные заболевания кишечника (ВЗК). Хотя точная этиология ВЗК не ясна, недавние эпидемиологические исследования показали сильную и дозозависимую связь между этими заболеваниями и употреблением антибиотиков. Исследования на мышах показали, что изменения в питании наряду с употреблением антибиотиков могут вызвать воспаление кишечника. Однако точный механизм этого явления до конца не изучен.
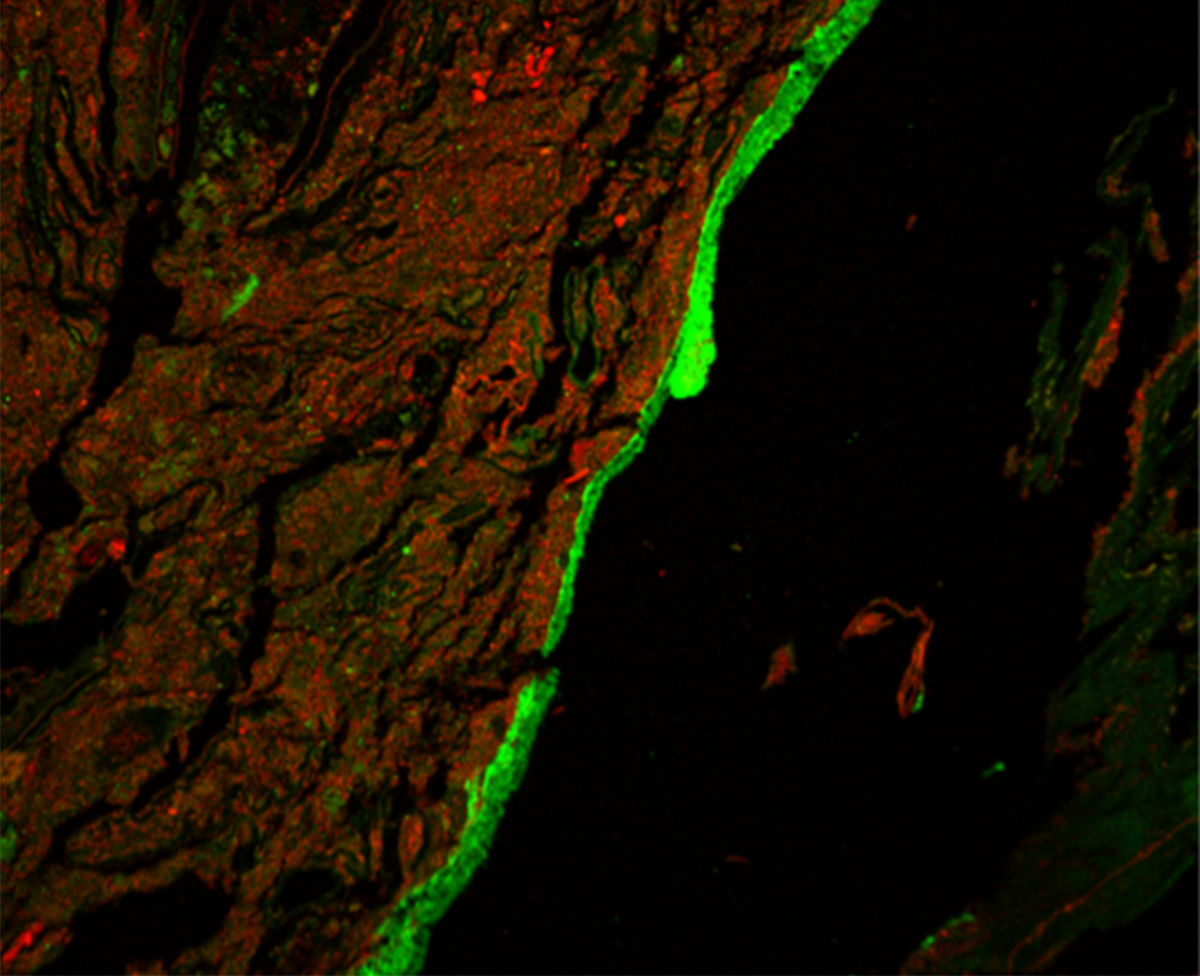
Слой слизи в толстой кишке отделяет хозяина от триллионов микробов, обитающих в просвете кишечника. Если этот слизистый барьер нарушается, бактерии могут проникнуть в кишечный эпителий хозяина и вызвать провоспалительную реакцию. Нарушение этого барьера является отличительной чертой ВЗК и, возможно, движущим фактором развития этих заболеваний. Терапия антибиотиками у мышей приводит к транслокации и поглощению бактерий в лимфатические узлы, дренирующие кишечник, и предрасполагает к развитию кишечного воспаления. Однако вопрос о том, повреждают ли антибиотики непосредственно слизистый барьер, остается неясным. В данном исследовании мы попытались проверить гипотезу о том, что антибиотики предрасполагают к развитию кишечного воспаления, нарушая слизистый барьер.
Мы обнаружили, что кратковременного перорального приема антибиотиков достаточно, чтобы нарушить разделение между хозяином и микробиотой в толстой кишке. Это явление было характерно для всех протестированных нами антибиотиков. Используя трансплантацию фекальной микробиоты и секвенирование РНК с последующим машинным обучением, мы пришли к выводу, что влияние ванкомицина на слизистый барьер не может быть перенесено на безмикробных мышей только за счет трансплантации микробиоты. Вместо этого мы обнаружили, что ванкомицин может препятствовать секреции слизи в толстой кишке независимым от микробиоты образом, вызывая ER-стресс (стресс эндоплазматического ретикулума) в клетках толстой кишки.
Неожиданно, но это влияние ванкомицина на способность бокаловидных клеток секретировать слизь было незамедлительным, так как через несколько минут после введения ванкомицина мы наблюдали резкое снижение скорости секреции слизи. Таким образом, мы пришли к выводу, что антибиотики оказывают пагубное влияние на слизистый барьер, частично воздействуя непосредственно на клетки хозяина. Важно отметить, что мы не исключаем пагубного влияния микробиоты на слизистый барьер, а скорее предполагаем, что существует и прямое воздействие на хозяина. Недавнее исследование показало, что трансплантация микробиоты от людей с историей употребления антибиотиков мышам может вызвать дефекты слизистого барьера у мышей.
Наше исследование не только отвечает на один вопрос (нарушает ли прием антибиотиков слизистый барьер?), но поднимает еще два вопроса. Первый из них: играет ли лечение антибиотиками причинную роль в развитии ВЗК? На этот вопрос трудно ответить в случае реальных людей-пациентов, поэтому его необходимо проверить на животных моделях ВЗК. Основная оговорка этого подхода заключается в том, что животные модели лишь частично отражают патологию и развитие ВЗК. Второй вопрос: как антибиотики нарушают выработку слизи? Наши эксперименты показывают, что некоторые антибиотики вызывают ER-стресс в клетках толстой кишки, тем самым снижая выработку слизи по уже известному ранее механизму. Неожиданным для нас оказалось то, что два антибиотика разных классов, неомицин и ванкомицин, вызывали стрессовый ответ ER в толстой кишке. Поскольку оба препарата обладают различными антимикробными механизмами, неясно, почему они могут вызывать ER-стресс в клетках хозяина. Было бы интересно проверить, повышает ли терапия антибиотиками риск развития ВЗК у пациентов с предрасполагающими мутациями в генах, связанных с аутофагией, поскольку аутофагия необходима для снятия стресса ER в бокаловидных клетках, чтобы обеспечить нормальную секрецию слизи. Мутации в генах, связанных с аутофагией, ассоциируются с развитием ВЗК.
Наша уверенность, что лечение ванкомицином предрасполагает к развитию кишечного воспаления путем ингибирования секреции слизи микробиота-независимым образом, ограничена доступными методами и самими экспериментальными условиями. Во-первых, поскольку у безмикробных мышей отсутствует полностью сформированный слой слизи, мы не можем определить, ингибирует ли ванкомицин секрецию слизи микробиото-независимым образом. Микробиота играет ключевую роль в формировании слоя слизи. Однако наш эксперимент показывает, что при введении препарата базолатерально (т.е. не в люминальную сторону, где обитают бактерии) ванкомицин снижает скорость секреции слизи в 2 раза в течение 45 мин. Такой быстрый ответ бокаловидных клеток на ванкомицин не может быть объяснен изменениями микробиоты. Во-вторых, воздействие на безмикробных мышей в модели химически индуцированного колита приводит к увеличению кровотечений и высокой смертности, но при этом признаки воспаления значительно меньше. Учитывая это, а также роль микроорганизмов в развитии кишечного воспаления, мы не можем проверить влияние ванкомицина на развитие кишечного воспаления в модели безмикробных мышей.
Таким образом, хотя наши наблюдения показывают, что ванкомицин влияет на организм хозяина независимым от микробиоты образом, причинная роль антибиотиков в развитии ВЗК еще нуждается в экспериментальном подтверждении.