Жизнь и смерть традиционно рассматриваются как противоположности, но возникновение новых многоклеточных форм жизни из клеток умершего организма представляет собой «третье состояние», которое находится за традиционными границами жизни и смерти.
Обычно ученые рассматривают смерть как необратимое прекращение функционирования организма в целом. Однако такие практики, как донорство органов, показывают, что органы, ткани и клетки могут продолжать функционировать даже после смерти организма. Такая жизнеспособность поднимает вопрос: какие механизмы позволяют определенным клеткам продолжать работать после смерти организма? В недавно опубликованном обзоре исследователи рассказывают о том, как некоторые клетки - при наличии питательных веществ, кислорода, биоэлектричества или биохимических сигналов - способны после смерти превращаться в многоклеточные организмы с новыми функциями.
Третье состояние бросает вызов тому, как ученые обычно понимают поведение клеток. Если метаморфозы гусеницы в бабочку или головастика в лягушку - это привычные трансформации в процессе развития, то случаи, когда организмы изменяются не по предопределенному сценарию, единичны. Опухоли, органоиды и клеточные линии, которые могут бесконечно делиться in vitro, как например клетки HeLa, не считаются частью третьего состояния, поскольку у них не развиваются новые функции.
Однако исследователи обнаружили, что клетки кожи, извлеченные из умерших эмбрионов лягушек, способны адаптироваться к новым лабораторным условиям, спонтанно реорганизуясь в многоклеточные организмы, названные ксеноботами. Эти организмы демонстрировали поведение, выходящее далеко за рамки их первоначальной биологической роли. В частности, ксеноботы использовали свои реснички для навигации и перемещения по окружающей среде, в то время как у живого эмбриона лягушки реснички обычно используются для переноса слизи. Ксеноботы также способны к кинематической саморепликации, то есть они могут физически воспроизводить свою структуру и функции без роста. Это отличается от более распространенных процессов репликации, которые предполагают рост внутри или на теле организма.
Исследователи также обнаружили, что одиночные клетки человеческих легких могут самособираться в миниатюрные многоклеточные организмы, способные передвигаться. Эти антроботы ведут себя и структурируются по-новому. Они способны не только ориентироваться в окружающей среде, но и восстанавливать как себя, так и поврежденные клетки нейронов, расположенные рядом. В совокупности эти находки демонстрируют присущую клеточным системам пластичность и опровергают идею о том, что клетки и организмы могут развиваться только предопределенными путями. Третье состояние предполагает, что смерть организма может играть важную роль в том, как жизнь трансформируется во времени.
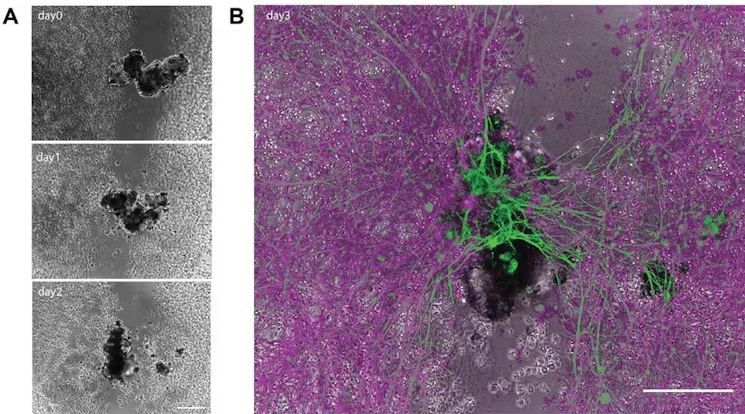
На фото A показано, как антропобот строит мостик через поврежденный нейрон в течение трех дней. На фото B зеленым цветом выделены «швы» в конце третьего дня. Фото: Gumuskaya et al. 2023/Advanced Science
На то, смогут ли определенные клетки и ткани выжить и функционировать после смерти организма, влияют несколько факторов. К ним относятся условия окружающей среды, метаболическая активность и методы консервации. Различные типы клеток имеют разное время выживания. Например, у человека лейкоциты погибают через 60-86 часов после смерти организма. У мышей клетки скелетных мышц могут быть выращены через 14 дней после смерти, а клетки фибробластов овец и коз можно культивировать до месяца или около того после смерти.
Метаболическая активность играет важную роль в том, смогут ли клетки продолжать выживать и функционировать. Активные клетки, требующие постоянного и значительного притока энергии для поддержания своей функции, культивировать сложнее, чем клетки с меньшими энергетическими потребностями. Такие методы сохранения, как криоконсервация, позволяют образцам тканей, например костному мозгу, функционировать так же, как и живые донорские источники.
Врожденные механизмы выживания также играют ключевую роль в том, будут ли клетки и ткани жить дальше. Например, исследователи наблюдали значительное повышение активности генов, связанных со стрессом, и генов, связанных с иммунитетом, после смерти организма, вероятно, чтобы компенсировать потерю гомеостаза. Кроме того, такие факторы, как травмы, инфекции и время, прошедшее с момента смерти, существенно влияют на жизнеспособность тканей и клеток.
Такие факторы, как возраст, состояние здоровья, пол и биологический вид, еще больше формируют посмертный ландшафт. Это прослеживается в проблеме культивирования и пересадки метаболически активных островковых клеток, которые вырабатывают инсулин в поджелудочной железе, от донора к реципиенту. Исследователи полагают, что аутоиммунные процессы, высокие энергетические затраты и деградация защитных механизмов могут быть причиной многих неудач при пересадке островковых клеток.
Как взаимодействие этих переменных позволяет определенным клеткам продолжать функционировать после смерти организма, остается неясным. Одна из гипотез заключается в том, что специализированные каналы и насосы, встроенные в наружные мембраны клеток, служат сложными электрическими цепями. Эти каналы и насосы генерируют электрические сигналы, которые позволяют клеткам общаться друг с другом и выполнять специфические функции, такие как рост и движение, формируя структуру организма, который они образуют. Степень, в которой различные типы клеток могут трансформироваться после смерти, также неясна. Предыдущие исследования показали, что специфические гены, участвующие в стрессе, иммунитете и эпигенетической регуляции, активируются после смерти у мышей, рыбок зебрафиш и людей, что говорит о широком потенциале трансформации среди различных типов клеток.
Третье состояние не только дает новое представление об адаптивности клеток. Оно также открывает перспективы для новых методов лечения. Например, антроботы могут быть получены из живых тканей человека, чтобы доставлять лекарственные препараты, не вызывая нежелательного иммунного ответа. Инженерные антроботы, введенные в организм, потенциально могут растворять бляшки в артериях у больных атеросклерозом и удалять избыток слизи у пациентов с муковисцидозом. Важно отметить, что эти многоклеточные организмы имеют ограниченный срок жизни, естественным образом разрушаясь через четыре-шесть недель. Этот «выключатель» предотвращает рост потенциально инвазивных клеток.
Лучшее понимание того, как некоторые клетки продолжают функционировать и преобразуются в многоклеточные образования через некоторое время после гибели организма, открывает новые перспективы для развития персонализированной и профилактической медицины.