Стрептококки группы B (GBS; Streptococcus agalactiae) - грамположительные, β-гемолитические бактерии, которые являются важной причиной неонатальной и младенческой заболеваемости и смертности.
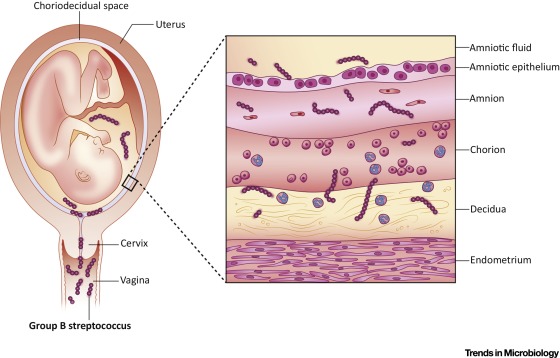
GBS обычно являются комменсальными организмами и колонизируют желудочно-кишечный тракт (ЖКТ) и нижние репродуктивные пути примерно у 20-25% женщин. Хотя присутствие GBS в этих нишах обычно бессимптомно, во время беременности GBS может подниматься из нижних половых путей в матку и инфицировать плод (Brokaw et al., 2021). Восходящая инфекция GBS может вызвать инвазивное заболевание у плода, что связано с повышенным риском неблагоприятных исходов беременности, включая преждевременные роды (ПР), мертворождение и повреждение органов плода.
Под заболеванием раннего возраста (ЗРВ) понимается инвазивное заболевание GBS, проявляющееся на первой неделе жизни, и считается, что оно возникает в результате инфицирования инвазивной GBS-инфекцией внутриутробно или во время рождения при контакте с вагинальной жидкостью; обычно такие случаи сопровождаются сепсисом, но в тяжелых случаях могут также включать пневмонию и/или менингит. Однако большинство случаев ЗРВ происходит в течение первых 24-48 часов жизни, что заставляет некоторых исследователей определять случаи ЗРВ как проявляющиеся в течение первых 72 часов после рождения (Lin et al., 2011; Berardi et al., 2019).
Когда инвазивная инфекция GBS развивается в период от 7 до 89 дней после рождения, это называется заболеванием с поздним началом (ЗПН). Пути передачи, лежащие в основе ЗПН, более сложны и связаны с различными источниками. Например, существует ограниченное количество исследований, выявивших передачу GBS новорожденному через грудное молоко (Elling et al., 2014; Buser et al., 2017; Tazi et al., 2019). Известно, что нозокомиальная передача может происходить у детей, рожденных от GBS-отрицательных матерей (Kim et al., 2006). Нозокомиальная передача GBS может также происходить среди младенцев, вскармливаемых молочными смесями (Anthony et al., 1979; Morinis et al., 2011). При ЗПН обычно наблюдается сепсис, но чаще инфекция переходит в менингит; другие клинические проявления ЗПН включают пневмонию, остеомиелит и/или септический артрит. Ежегодно в мире примерно у 205 000 новорожденных диагностируется ЗВР и у 114 000 - ЗПН.
Патогенез инвазивных GBS-инфекций у новорожденных и грудных детей сложен, и не существует единого подхода для предотвращения всех случаев ПР, ЗРВ и ЗПН. Для успешного снижения инвазивных заболеваний GBS и неблагоприятных исходов у новорожденных потребуется многофакторный подход, например, сочетающий скрининг, антибиотики и вакцинацию. Для разработки эффективной терапии необходимо больше знаний, чтобы определить, как использование факторов вирулентности GBS влияет на пути передачи и распространение инфекции среди новорожденных. Ранее мы описали бактериальные детерминанты инвазивного заболевания GBS при беременности, проследив восхождение GBS из колонизированного вагинального тракта в матку и через плаценту (Brokaw et al., 2021). В данном обзоре мы сосредоточились на GBS-инфекциях новорожденных, обобщая эпидемиологию, последствия инвазивного заболевания и пути распространения GBS в организме младенца. Мы также определяем факторы вирулентности GBS, которые обеспечивают распространение в органы-мишени новорожденных и грудных детей и усиливают заболевание.
В этом обзоре мы рассматриваем, как GBS использует уязвимость иммунной защиты для возникновения и распространения инфекции в легких, кишечнике и головном мозге новорожденных. Патогенез инвазивного заболевания, вызванного GBS, зависит от способности организма преодолевать барьеры хозяина. Использование животных моделей, которые в точности отражают передачу GBS от матери к ребенку и приобретение патогена младенцем, сыграло решающую роль в определении того, как эти бактерии используют неразвитую иммунную систему новорожденных для распространения и патогенеза.
GBS экспрессирует различные факторы вирулентности, включая капсульные полисахариды, гемолитический пигмент, адгезины и внеклеточные ферменты, которые могут действовать совместно, чтобы подорвать, противодействовать иммунным реакциям, способствующим распространению GBS среди новорожденных. Многие из этих факторов вирулентности являются критическими для колонизации и/или инвазии GBS в различные ниши хозяина, что приводит к неонатальному заболеванию. Хотя скрининг GBS в сочетании с интранатальной антибиотикопрофилактикой был успешным в снижении инвазивного заболевания, появление резистентных к антибиотикам штаммов GBS вызывает опасения относительно долгосрочной эффективности этого подхода.
Выяснение механизмов колонизации, инвазии и патогенеза GBS, приводящих к ЗВР или ЗПН, является ключом к обнаружению новых антимикробных мишеней, которые позволят разработать новые терапевтические средства и стратегии профилактики для лучшего контроля и предотвращения инвазивного заболевания GBS у новорожденных. Полное выяснение молекулярной основы взаимодействия между GBS и новорожденными будет иметь важное значение для достижения этой цели.