Десять лет назад Дженнифер Дудна и ее коллеги опубликовали результаты эксперимента по изучению генов бактерий.
Когда это исследование было опубликовано в журнале Science 28 июня 2012 года, оно не попало в заголовки новостей. Фактически, в течение следующих нескольких недель оно вообще не стало новостью. Оглядываясь назад, Дудна, биохимик Калифорнийского университета в Беркли, задается вопросом, не связано ли это недоразумение с необычным названием, которое она и ее коллеги выбрали для исследования: "Программируемая двойная РНК-управляемая ДНК-эндонуклеаза в адаптивном бактериальном иммунитете". "Полагаю, если бы я писала статью сегодня, я бы выбрала другое название", - признается Дудна.
"Но я помню, что очень четко подумала: когда мы опубликуем эту работу, это будет похоже на выстрел стартового пистолета в гонке", - сказала она.
Всего за десять лет CRISPR стал одним из самых знаменитых изобретений в современной биологии. Он стремительно меняет методы изучения болезней: биологи-онкологи используют этот метод для обнаружения скрытых уязвимостей опухолевых клеток, врачи - для редактирования генов, вызывающих наследственные заболевания. "Эра редактирования генов человека не наступает", - говорит Дэвид Лю, биолог из Гарвардского университета. "Она уже наступила".
Но влияние CRISPR простирается далеко за пределы медицины. Эволюционные биологи используют эту технологию для изучения мозга неандертальцев и выяснения того, как наши предки-обезьяны потеряли хвосты. Биологи, изучающие сельскохозяйственные растения, редактируют семена, чтобы получить культуры с новыми витаминами или способностью противостоять заболеваниям. Некоторые из них могут попасть на полки супермаркетов уже в ближайшие несколько лет.
CRISPR оказал такое быстрое воздействие, что Дудна и ее коллега Эммануэль Шарпантье из берлинского Института Макса Планка по изучению патогенов получили в 2020 году Нобелевскую премию по химии. Комитет по присуждению премии назвал их исследование 2012 года "эпохальным экспериментом".
Тем не менее, Дудна уже в самом начале осознала, что CRISPR поставит ряд острых этических вопросов, и после десятилетия его развития эти вопросы актуальны как никогда. Накормит ли грядущая волна сельско-хозяйственных культур, измененных с помощью CRISPR, мир и поможет ли она бедным фермерам или только обогатит гигантов агробизнеса, инвестирующих в эту технологию? Улучшит ли медицина на основе CRISPR здоровье уязвимых слоев населения по всему миру, или за нее придется заплатить миллион долларов?
Наиболее глубокий этический вопрос, связанный с CRISPR, заключается в том, как будущие поколения могут использовать эту технологию для изменения человеческих эмбрионов. Это предположение было просто мыслительным предположением до 2018 года, когда Хе Цзянькуй, биофизик из Китая, отредактировал ген в человеческих эмбрионах, чтобы придать им устойчивость к вирусу гепатита В. Три модифицированных эмбриона были имплантированы женщинам в китайском городе Шэньчжэнь. В 2019 году суд приговорил Хе к тюремному заключению за "незаконную медицинскую практику". В апреле MIT Technology Review сообщил, что он недавно вышел на свободу. О здоровье трех детей, которые сейчас находятся в ясельном возрасте, мало что известно.
Ученые пока не знают никого, кто последовал бы примеру Хе. Но по мере дальнейшего совершенствования CRISPR редактирование человеческих эмбрионов может в конечном итоге стать безопасным и эффективным методом лечения различных заболеваний. Станет ли тогда приемлемым или даже обычным делом исправление вызывающих заболевания генов в эмбрионе в лаборатории? А что если родители захотят вставить в эмбрион черты, которые они считают более желательными, например, связанные с ростом, цветом глаз или интеллектом? Франсуаза Бейлис, специалист по биоэтике из Университета Далхаузи в Новой Шотландии, опасается, что общественность все еще не готова к решению подобных вопросов. "Я скептически отношусь к глубине понимания публики того, о чем идет речь", - сказала она. "Есть разница между тем, чтобы сделать людей лучше, и тем, чтобы создать лучших людей".
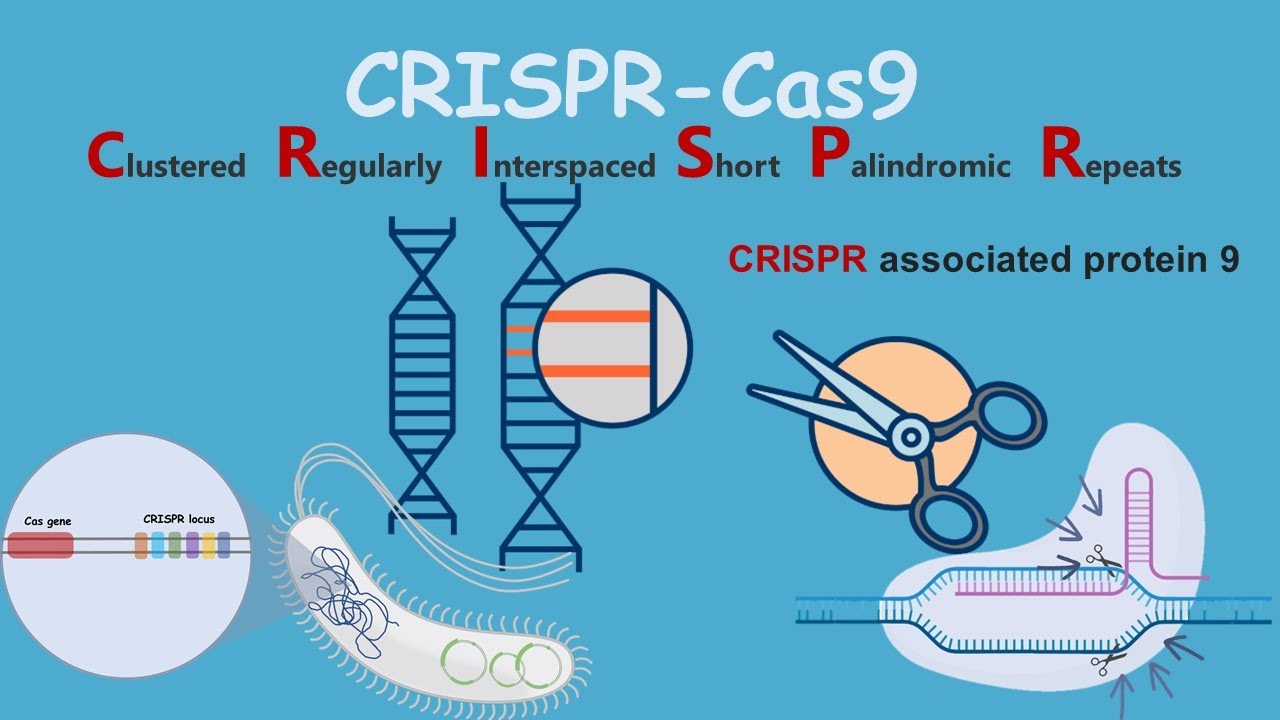
Дудна и Шарпантье не изобрели свой метод редактирования генов с нуля. Они позаимствовали свои молекулярные инструменты у бактерий. В 1980-х годах микробиологи обнаружили у бактерий загадочные участки ДНК, которые впоследствии назвали Clustered Regularly Interspaced Short Palindromic Repeats (короткие палиндромные повторы, регулярно расположенные группами) - CRISPR. Дальнейшие исследования показали, что бактерии используют эти последовательности CRISPR в качестве оружия против вторгшихся вирусов. Бактерии превращают эти последовательности в РНК, которая может точно прикрепляться к короткому участку генов вторгшегося вируса. Эти молекулы РНК несут с собой белки, которые действуют как молекулярные ножницы, разрезая вирусные гены и останавливая инфекцию.
Изучая CRISPR, Дудна и Шарпантье поняли, что эта система может позволить им разрезать последовательность ДНК по своему усмотрению. Все, что для этого нужно, - создать подходящий фрагмент РНК. Чтобы проверить эту революционную идею, они создали партию идентичных фрагментов ДНК. Затем они создали еще одну партию молекул РНК, запрограммировав их так, чтобы все они находились в одном и том же месте ДНК. Наконец, они смешали ДНК, РНК и молекулярные ножницы в пробирках. И обнаружили, что многие молекулы ДНК были разрезаны точно в нужном месте.
В течение нескольких месяцев Дудна руководила серией круглосуточных экспериментов, чтобы проверить, может ли CRISPR работать не только в in vitro, но и в живых клетках. Она настойчиво подгоняла свою команду, подозревая, что многие другие ученые также находятся в погоне. Эта догадка вскоре оказалась верной. В январе 2013 года пять групп ученых опубликовали исследования, в которых они успешно использовали CRISPR в клетках живых животных или человека. По сути Дудна не выиграла эту гонку; первые две опубликованные работы были получены из двух лабораторий в Кембридже, одна из Института Броуд при МТИ и Гарварде, а другая из Гарварда.
Лукас Доу, биолог-онколог из Weill Cornell Medicine, хорошо помнит, как узнал о возможностях CRISPR. "При чтении статей это выглядело потрясающе", - вспоминает он. Вскоре Доу и его коллеги обнаружили, что метод надежно вырезает фрагменты ДНК в раковых клетках человека. Биологи-онкологи начали систематически изменять каждый ген в раковых клетках, чтобы выяснить, какие из них имеют значение для развития заболевания. Исследователи компании KSQ Therapeutics, также расположенной в Кембридже, с помощью CRISPR обнаружили ген, который, например, необходим для роста определенных опухолей, и в прошлом году они начали клинические испытания препарата, блокирующего этот ген. Компании Caribou Biosciences, соучредителем которой является Дудна, и CRISPR Therapeutics, соучредителем которой является Шарпантье, проводят клинические испытания препаратов CRISPR, которые борются с раком другим способом: путем редактирования иммунных клеток для более агрессивного воздействия на опухоли.
Эти и некоторые другие компании также используют CRISPR, чтобы попытаться обратить вспять наследственные заболевания. 12 июня исследователи из CRISPR Therapeutics и биотехнологической компании Vertex представили на научной встрече новые результаты клинических испытаний с участием 75 добровольцев, страдающих серповидно-клеточной анемией или бета-талассемией при которой нарушается синтез гемоглобина. Исследователи воспользовались тем, что у человека имеется более одного гена гемоглобина. Одна копия, называемая фетальным гемоглобином, обычно активна только у плода и прекращает свою работу через несколько месяцев после рождения. Они извлекли незрелые клетки крови из костного мозга добровольцев и затем с помощью CRISPR вырезали переключатель, который обычно выключает ген фетального гемоглобина. Когда отредактированные клетки были возвращены пациентам, они смогли развиться в эритроциты богатые гемоглобином.
Выступая на недавней конференции по гематологии, авторы сообщили, что из 44 пациентов с бета-талассемией, прошедших лечение, 42 больше не нуждаются в регулярных переливаниях крови. Ни один из 31 пациента с серповидно-клеточной анемией не испытывал болезненных снижений уровня кислорода, которые в обычных условиях привели бы их в больницу. CRISPR Therapeutics и Vertex рассчитывают до конца года обратиться к государственным регулирующим органам с просьбой одобрить этот метод лечения.
Другие компании вводят молекулы CRISPR непосредственно в организм. Компания Intellia Therapeutics, соучредителем которой также является Дудна, объединилась с компанией Regeneron, чтобы начать клинические испытания для лечения транстиретинового амилоидоза - редкого заболевания, при котором поврежденный белок печени становится смертельно опасным, поскольку накапливается в крови. Врачи вводили молекулы CRISPR в печень добровольцев, чтобы выключить дефектный ген. Выступая на научной конференции пару недель назад, исследователи компании Intellia сообщили, что одна доза препарата привела к значительному снижению уровня белка в крови добровольцев на целый год.
Та же технология, которая позволяет медицинским исследователям изменять человеческие клетки, позволяет ученым-аграриям изменять гены сельскохозяйственных культур. Когда появилась первая волна исследований CRISPR, Катрин Фойе, эксперт по пшенице, работавшая тогда во Французском национальном институте сельскохозяйственных исследований, сразу же увидела потенциал этой технологии для своей работы. "Я сказала: "Боже мой, теперь у нас есть инструмент", - говорит она. В компании Inari Agriculture, расположенной в Кембридже, д-р Фойе курирует работу по использованию CRISPR для выведения сортов сои и других культур, которые потребляют меньше воды и удобрений. За пределами США британские исследователи использовали CRISPR для выведения томата, способного вырабатывать витамин D.
Кевин Пиксли, ученый-растениевод из Международного центра улучшения кукурузы и пшеницы в Мехико, говорит, что CRISPR важен для селекции растений не только потому, что он мощный, но и потому, что он относительно дешевый. Даже небольшие лаборатории могут создавать устойчивые к болезням маниоки или засухоустойчивые бананы, что может принести пользу бедным странам, но не заинтересует компании, стремящиеся к большим финансовым доходам.
Из-за того, что CRISPR используется в столь разных отраслях, его патент стал предметом длительного спора. Группы под руководством Института Броуда и Калифорнийского университета подали патенты на оригинальную версию редактирования генов на основе CRISPR-Cas9 в живых клетках. Институт Броуда выиграл патент в 2014 году, а Калифорнийский университет ответил на это судебным разбирательством. В феврале этого года Судебный и апелляционный совет по патентам США вынес решение, которое, скорее всего, является последним словом в этом споре. Они вынесли решение в пользу Института Броуда. Джейкоб Шеркоу, эксперт по биотехнологическим патентам в Университета Иллинойса, прогнозирует, что компании, которые лицензировали технологию CRISPR у Калифорнийского университета, должны будут соблюдать патент Института Броуда. "Крупные компании, занимающиеся CRISPR, те, которые находятся дальше всех в клинических испытаниях, почти наверняка должны будут выписать Институту Броуда очень большой чек", - говорит он.
Оригинальная система CRISPR, известная как CRISPR-Cas9, оставляет много возможностей для совершенствования. Молекулы хорошо вырезают ДНК, но не так хорошо вставляют на ее место новые фрагменты. Иногда CRISPR-Cas9 промахивается мимо цели, вырезая ДНК не в том месте. И даже когда молекулы выполняют свою работу правильно, клетки могут совершать ошибки, восстанавливая оставленные свободные концы ДНК. Ряд ученых изобрели новые версии CRISPR, которые устраняют некоторые из этих недостатков. Например, Лю и его коллеги из Гарварда использовали CRISPR для того, чтобы сделать надрез в одной из двух нитей ДНК, а не разрывать их полностью. Этот процесс, известный как редактирование оснований, позволяет точно изменить одну генетическую букву ДНК с гораздо меньшим риском генетического повреждения.
Лю стал одним из основателей компании Beam Therapeutics, которая занимается созданием препаратов для редактирования оснований. В конце этого года компания испытает свой первый препарат на пациентах с серповидно-клеточной анемией. Лю и его коллеги также присоединили молекулы CRISPR к белку, который вирусы используют для вставки своих генов в ДНК хозяина. Этот новый метод, называемый прайм-редактированием, может позволить CRISPR изменять более длинные участки генетического материала. "Прайм-редакторы - это что-то вроде текстовых процессоров ДНК", - говорит Лю. "Они фактически выполняют функцию поиска и замены в ДНК". Родольф Баррангу, эксперт по CRISPR в Университете штата Северная Каролина и основатель компании Intellia Therapeutics, предсказал, что прайм-редакторы со временем станут частью стандартного набора инструментов CRISPR. Но пока, по его словам, эта техника все еще слишком сложна для широкого применения. "Она еще не готова к премьере, как бы это ни звучало", - сказал он.
Такие достижения, как редактирование праймеров, еще не существовали в 2018 году, когда Хе отправился редактировать человеческие эмбрионы в Шэньчжэне. Он использовал стандартную систему CRISPR-Cas9, которую Дудна и другие ученые разработали много лет назад. Хе надеялся наделить детей устойчивостью к ВИЧ, вырезав из ДНК эмбрионов часть гена под названием CCR5. Люди, которые от природы являются носителями такой мутации, редко заболевают ВИЧ-инфекцией. В ноябре 2018 года Хе объявил, что пара девочек-близнецов родилась с его геном. Это заявление застало многих ученых, таких как Дудна, врасплох, и они резко осудили его за то, что он подверг здоровье малышей опасности с помощью непроверенных процедур.
Бейлис из Университета Далхаузи раскритиковал Хе за то, как он, по сообщениям, представил процедуру родителям, преуменьшив значение радикального эксперимента, который они собирались провести. "Вы не смогли бы получить информированное согласие, если бы сказали: "Это просто эксперимент. Никто никогда этого не делал", - сказала она. В течение почти четырех лет после заявления Хе ученые продолжали использовать CRISPR на человеческих эмбрионах. Но они изучают эмбрионы только тогда, когда они представляют собой крошечные сгустки клеток, чтобы найти ответы на вопросы о самых ранних стадиях развития. Эти исследования потенциально могут привести к новым методам лечения бесплодия.
Бике Бекаерт, специалист по репродуктивной биологии в Гентском университете в Бельгии, говорит, что CRISPR по-прежнему сложно использовать на человеческих эмбрионах. Нарушение ДНК в этих клетках может привести к радикальным перестройкам в хромосомах. "Это сложнее, чем мы думали", - заявила она, будучи ведущим автором недавнего обзора по этому вопросу. "Мы действительно не понимаем, что происходит". Тем не менее, Бекаерт не теряет надежды, что редактирование праймеров и другие усовершенствования CRISPR позволят ученым вносить достоверно точные изменения в человеческие эмбрионы.
"Пять лет - это слишком мало, но я думаю, что при моей жизни это может произойти", - говорит она.