Микробиота кишечника может иметь решающее значение для успеха или неудачи иммунотерапии. Донорский кал может дать онкологам возможность изменить баланс, но настоящее беспокойство вызывает то, что будет дальше.
В феврале 2021 года были опубликованы результаты двух замечательных клинических исследований. В каждом из них участвовали пациенты с меланомой. Некоторые участники успешно прошли лечение с помощью препаратов, называемых ингибиторами иммунных контрольных точек, которые помогают организму уничтожать раковые клетки. Другие не смогли ответить на лечение.
В обоих исследованиях ученые собрали образцы кала у людей, которым помогла иммунотерапия. Затем они пересадили эти образцы и содержащиеся в них кишечные бактерии людям, не ответившим на лекарства, и снова ввели им ингибиторы контрольных точек. Предполагалось, что такая трансплантация фекальной микробиоты (ТФМ) передаст способность реагировать на потенциально спасительное лечение.
Эксперименты на мышах уже позволили предположить, что различия в составе микробиома кишечника людей могут объяснить большую часть пресловутой вариабельности реакции на ингибиторы контрольных точек. Мыши, которым пересаживали микробов из кишечника людей, положительно отреагировавших на иммунотерапию, тоже, как правило, отвечали положительно. Но когда пересаживали микробы от людей, не ответивших на иммунотерапию, препараты оказывались неэффективными. По словам Хассана Зарура, онколога из Питтсбургского университета, возглавлявшего одно из клинических испытаний, эти нетрадиционные методы привлекли множество добровольцев. «Люди очень хотят либо попробовать что-то другое, когда у них нет другого выхода, либо помочь другим чем-то, что легко предоставить».
В исследовании Зарура 6 из 15 человек, прошедших ТФМ, получили пользу от той же формы иммунотерапии, которая ранее им ничем не помогла. Во втором исследовании, проведенном под руководством ученых из Медицинского центра Шиба (Израиль), трое из десяти участников стали респондерами после трансплантации. «Полученные данные были очень впечатляющими и убедительными, хотя и очень предварительными, - рассказывает Зарур.
В прошлом году Бертран Раути, онколог из Монреальского университета (Канада), стал одним из руководителей исследования, в котором приняли участие 20 человек с меланомой. После курса ТФМ 13 человек ответили на ингибиторы контрольных точек, а 4 достигли полной ремиссии. Однако в этот раз микробы для имплантации были взяты у здоровых добровольцев, а не у людей, уже получивших положительный ответ на иммунотерапию, что значительно расширило потенциальный круг доноров стула.
Предварительные результаты исследования, в котором ТФМ проводилась перед иммунотерапией первой линии двумя ингибиторами контрольных точек, также свидетельствуют об успехе - около трех четвертей людей ответили на препараты, по сравнению с историческим средним показателем в 58%, когда ТФМ не использовалась. «Это сопровождалось действительно выраженной эффективностью», - утверждает онколог Ариэль Элкриф из Монреальского университета. Теперь группа начнет большое рандомизированное исследование на пациентах с меланомой.
Но многие онкологи хотят двигаться дальше - настолько, что ТФМ может устареть почти так же быстро, как и появилась. «ТФМ - это ступенька», - считает Дженнифер Варго, исследователь рака в онкологическом центре MD Anderson в Хьюстоне. Вместо этого она и другие исследователи хотят создавать стандартизированные наборы известных бактерий, чтобы более контролируемо изменять микробиом кишечника. Другие ученые намерены полностью отказаться от живых бактерий и разработать препараты, нацеленные на молекулярные механизмы, с помощью которых микробиом влияет на ответы иммунотерапии.
ТФМ доказала, что изменение микробиома кишечника больного раком человека может спасти ему жизнь, и стала эталоном, по которому будут оценивать перспективные методы лечения.
Иммунотерапия рака позволяет иммунной системе распознавать злокачественные клетки как чужеродные объекты и использовать Т-клетки для их уничтожения. Ингибиторы контрольных точек связываются с белками контрольных точек, которыми манипулируют некоторые виды рака для подавления активности Т-клеток, и сводят их на нет. При правильных обстоятельствах это позволяет иммунным клеткам атаковать и уничтожать раковые опухоли.
Клинические испытания, проведенные в 2000-х годах, показали, что ингибиторы контрольных точек эффективны против некоторых ранее не поддававшихся лечению опухолей. Однако реакция на эти препараты сильно различается. Самые высокие шансы на успех - при меланоме: вероятность того, что лечение сработает, примерно равна выпадению орла или решки. При раке легких шансы ближе к вероятности выпадения шестерки на кубике. «Разница между пациентами заключается в величине эндогенного иммунного ответа, - поясняет Томас Гаевски, онколог из Чикагского университета. Чтобы повысить шансы, исследователям необходимо понять, от чего зависит иммунный ответ больных раком. На это влияет множество факторов - не в последнюю очередь то, насколько иммуногенна сама опухоль. Кроме того, давно известно, что экосистема из триллионов бактерий, живущих в кишечнике человека, влияет на его иммунные функции.
В 2015 году группа Гаевски продемонстрировала, что мыши с меланомой, имеющие разные микробиомы кишечника, по-разному реагируют на лечение ингибиторами контрольных точек. Один род бактерий - Bifidobacterium - оказался ключевым для их способности реагировать. В то же время группа специалистов из Онкологического кампуса имени Гюстава Русси в Париже показала, что введение бактерий Bacteroidales мышам, не имеющим кишечного микробиома, может заставить их реагировать. Три года спустя Гаевски и его коллеги показали, что кишечник людей, ответивших на иммунотерапию, содержит различные виды бактерий, а пересадка микробиомов участников в организм мышей в целом заставляет грызунов реагировать на лечение так же, как и доноры. Эти результаты были опубликованы одновременно с двумя аналогичными работами - парижской группы и группы Варго.
По словам Гаевски, эксперименты по трансплантации от человека мышам позволяют предположить, что примерно у половины людей, которые не отвечают на ингибиторы контрольных точек, виноват микробиом кишечника. «Если позаботиться о микробиоме, можно удвоить скорость ответа». Эта заманчивая возможность может привести к тому, что скрининг микробиома кишечника станет рутинным предшественником иммунотерапии. Но разработка надежных методов лечения - сложная задача. «Чем больше мы продвигаемся вперед, тем более сложной представляется нам эта экосистема», - говорит Раути.
Варго видит пути, по которым эти результаты могут быстро изменить клиническую практику. В 2021 году ее группа показала, что люди с высоковолокнистой диетой лучше реагируют на ингибиторы контрольных точек, чем люди с низковолокнистой диетой. Ее коллеги из MD Anderson работают над испытаниями для официальной оценки эффективности диет с высоким содержанием клетчатки, и Варго считает, что увеличение потребления клетчатки может вскоре стать стандартным советом для людей, принимающих ингибиторы контрольных точек.
Несколько исследований также связали прием антибиотиков, которые могут сильно истощить микробиом кишечника, с худшими результатами иммунотерапии. Сокращение их использования у людей, проходящих иммунотерапию, может помочь, говорит Варго. Если избежать приема антибиотиков не удается, могут потребоваться восстановительные меры. «Если кто-то принимает антибиотики широкого спектра действия, ему может потребоваться такая радикальная мера, как пересадка всего фекального содержимого, чтобы он смог по-настоящему отреагировать», - подчеркивает она.
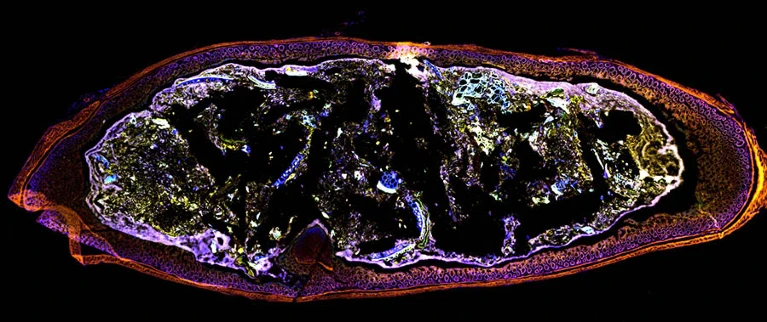
Изображение поперечного сечения толстой кишки мыши, которая была колонизирована живыми бактериями (показаны светло-фиолетовым цветом). Фото: Kanvas Bio/Jennifer Wargo laboratory.
Обнадеживающие результаты испытаний ТФМ, проведенных Заруром, Раути, Элкриф и другими, активизировали усилия по разработке способов прямого изменения микробиома кишечника людей с раком. Эталонный пример ТФМ - ее использование для лечения рецидивирующих инфекций Clostridium difficile. Трансплантация от здоровых доноров является эффективным средством лечения этого изнурительного кишечного заболевания, и с 2013 года эта процедура получила одобрение регулирующих органов в США.
Однако практические проблемы, такие как трудности с набором доноров, жесткие требования к обследованию и нежелание врачей принимать участие в клинических исследованиях, сдерживают распространение этой практики. Врачи также опасаются, что человеческий кал - это несовместимое с реальностью средство. «Вы не знаете, есть ли у донора нужные бактерии, и вы не знаете, какие бактерии нужны реципиенту», - поясняет Гаевски.
Примечательно, что в прошлом году две компании получили одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США на специальные бактериальные консорциумы для лечения рецидивирующих инфекций C. difficile. Определенные наборы микробов должны быть более надежными и воспроизводимыми методами лечения и могут свести на нет некоторые опасения, связанные с безопасностью ТФМ, такие как возможность передачи патогенов. Эти разработки вдохновляют многих исследователей, которые пытаются создать микробиомы для усиления иммунотерапии рака. «Мы уже прочли всю историю про C. diff.», - иронизирует Надим Аджами, исследователь микробиома, который вместе с Варго работает в MD Anderson над созданием бактериальных консорциумов для иммунотерапии. «Очень важно перейти к более масштабируемому и воспроизводимому препарату».
Однако первые попытки создать бактериальные консорциумы не увенчались успехом. Аджами говорит, что большинство компаний, участвовавших в этом, либо перешли в другие области, либо вообще прекратили свою деятельность. Одна из проблем заключается в том, что исследования, обнаружившие различия между микробиомами респондеров и нереспондеров в небольших когортах, не смогли прийти к набору микробов кишечника, которые надежно предсказывают реакцию на иммунотерапию в разных местах исследования. Поэтому в 2022 году гастроэнтеролог Лаура Болте из Университета Гронингена (Нидерланды) выступила одним из руководителей мета-анализа, в котором объединила данные из нескольких источников, чтобы изучить микробиомы и клинические исходы у 165 пациентов. Она надеялась, что большой размер выборки внесет ясность, но «это не так просто», - говорит она. «Все гораздо сложнее, чем просто видовые различия между ответившими и не ответившими».
Болте и ее коллега Йоханнес Бьорк, исследователь микробиома из Гронингенского университета, считают, что, возможно, необходимо выйти за рамки видового уровня и составить каталог подвидов и штаммов бактерий. Эту гипотезу подтверждает небольшое исследование, опубликованное в марте, в котором было показано, что такой более тонкий анализ улучшает прогноз реакции на ингибиторы контрольных точек у людей с некоторыми видами рака. Другая возможность заключается в том, что исследователи должны сосредоточиться на функциях кишечных бактерий. Например, два вида микроорганизмов могут оказывать одинаковое воздействие, если они выделяют один и тот же метаболит.
В отличие от работы Болте, мета-анализ 2022 года, проведенный Заруром и его коллегами, позволил связать некоторые виды бактерий с положительным ответом на ингибиторы контрольных точек. Однако, по словам Зарура, он выявил гораздо более выраженные признаки у тех, кто не реагирует на ингибиторы, что позволяет предположить, что удаление нежелательных микробов может быть более важным, чем доставка «хороших».
Исследователи надеются, что интервенционные исследования покажут, что работает на практике. Например, Раути подчеркивает, что центральной частью проводимых клинических испытаний ТФМ является тщательный мониторинг микробных изменений, чтобы определить, какие бактерии могут быть наиболее эффективными компонентами стандартизированной микробной терапии. «Мы будем действительно понимать, как работают эти вмешательства», - говорит он. «Затем мы сможем разработать следующее поколение микробиомных терапевтических средств».
Другие группы используют метод ТФМ между людьми и мышами для определения характеристик эффективных бактерий. Гаевски и его коллеги не забывают о том, что им, вероятно, придется искать способ борьбы с проблемными микробиомами кишечника и воссоздали микробиомы людей, не отвечающих на лечение на мышах, пытаясь обнаружить бактерии, которые могут «конкурировать с теми, что уже есть, и поменять ситуацию, чтобы мыши стали отвечать на лечение». Гаевски прогнозирует, что потребуется определенная степень персонализации, и что для удовлетворения потребностей отдельных людей могут потребоваться различные бактериальные консорциумы. Он надеется начать клинические испытания адаптированных бактериальных консорциумов в ближайшие два года.
Аджами отмечает, что каждые несколько месяцев он приглашает в MD Anderson женщину, которая в настоящее время находится в состоянии ремиссии от рака толстой кишки после лечения ингибитором контрольных точек три года назад. Она уже сдала кал для использования в текущем клиническом испытании ТФМ, а теперь предоставляет образцы и в лабораторию Аджами. Ученые используют методы, направленные на поддержание сложных бактериальных экосистем, которые процветают в безвоздушных условиях кишечника. В течение 15 минут после опорожнения кишечника бактерии культивируются в анаэробных камерах. Позже их вводят в мышиные модели рака и оценивают их влияние на результаты иммунотерапии. Аджами надеется начать испытания микробных консорциумов на людях в следующем году.
Однако некоторые исследователи не уверены в том, что введение микробов - даже в тщательно рассчитанных смесях - является наилучшей стратегией. «Лично я сомневаюсь в использовании живых бактерий», - говорит Франческа Газзанига, изучающая физиологическое воздействие микробиома в Гарвардской медицинской школе. Она опасается, что вновь введенные бактерии могут либо погибнуть, либо потерять свои противоопухолевые свойства у людей с проблемным микробиомом. Вместо этого Газзанига предпочитает обходить бактерии стороной. Она надеется раскрыть механизмы, с помощью которых микробиом кишечника влияет на иммунитет при раке, и разработать обычные лекарства, использующие те же механизмы для достижения положительных результатов иммунотерапии. «Давайте просто полностью обойдем необходимость иметь правильный микробиом», - говорит она.
Однако точные механизмы, на которые должны воздействовать эти лекарства, по словам Гаевски, остаются «немного черным ящиком». Он объясняет, что существует несколько потенциальных механизмов, включая прямое взаимодействие между бактериями и иммунными клетками кишечника, взаимодействие между бактериальными метаболитами и иммунными клетками кишечника, а также попадание бактериальных метаболитов в кровоток и их системное действие.
В 2015 году Газзанига попыталась решить эту проблему - она искала различия в экспрессии иммунных генов между мышами, чей кишечник был колонизирован здоровой человеческой микробиотой и отвечал на ингибиторы контрольных точек, и мышами, чей микробиом был уничтожен антибиотиками и не отвечал. Исследователи обнаружили, что в некоторых иммунных клетках в дренирующих лимфатических узлах мышей, получавших антибиотики, уровень малоизученного белка PD-L2 был заметно повышен. Этот белок является двоюродным братом PD-L1, активирующего контрольные точки белка, производимого некоторыми раковыми клетками, на подавление Т-клеток которых направлено действие большинства используемых в настоящее время ингибиторов контрольных точек. Более того, в Т-клетках мышей, которые не реагировали на ингибиторы контрольных точек, был повышен уровень ингибирующего рецептора, активируемого PD-L2.
Тогда Газзанига задалась вопросом, можно ли дополнить обычный ингибитор контрольных точек антителами, блокирующими PD-L2, чтобы эти обычно нечувствительные мыши ответили на иммунотерапию. Это был успех: оба препарата сократили опухоли даже у мышей, не имеющих микробов в кишечнике. Кроме того, она показала, что мыши, колонизированные кишечными бактериями некоторых участников испытания Варго, не отвечавших на терапию, реагировали на ингибиторы контрольных точек, когда им вводили антитела, нацеленные на PD-L2. Полученные результаты свидетельствуют о том, что некоторым больным раком может помочь сочетание PD-L2-таргетных препаратов с существующими вариантами иммунотерапии. «Это может сработать во многих случаях», - уверена Газзанига.
«Существует множество механизмов, с помощью которых микробиом может влиять на противоопухолевый иммунитет, и это был один из них», - добавляет она. «Нам нужно продолжать искать другие».
Антитела к PD-L2 и определенные смеси живых бактерий, вероятно, будут более масштабируемыми и иметь более постоянный состав, чем ТФМ, и их разработчики уверены, что они добьются успеха. Если это так, то ТФМ может стать не более чем незначительной заметкой в развитии более совершенных методов лечения.
Представив такой взгляд на будущее, Раути и Элкриф согласны с тем, что использование ТФМ для лечения инфекций, вызванных C. difficile, выявило множество проблем. «С этой терапией связано множество логистических трудностей", - говорит Элкриф. Большинство биотехнологических компаний не заинтересованы в ТФМ, добавляет она, и предпочли бы разрабатывать более целенаправленные методы лечения. Но Раути считает, что если испытания ТФМ для лечения рака продолжат приносить положительные результаты, ученые и врачи найдут способы применить ее в клинической практике. Каким бы ни был ажиотаж, связанный с другими подходами, говорит он, пока что ТФМ - единственная стратегия с надежными клиническими данными, подтверждающими ее способность улучшать результаты иммунотерапии.
"Сейчас у нас есть пациенты, которые все еще живы, свободны от рака, спустя четыре года после первого испытания, - говорит он. "В конечном итоге именно этот показатель имеет наибольшее значение".

