83-летняя женщина с диабетом 2 типа в анамнезе поступила в отделение неотложной помощи с двухмесячной дизурией и диареей.
При поступлении были проведены тесты в отношении Clostridiodes difficile, культура мочи и 2 набора образцов культуры крови. Тест на C. difficile был положительным на антиген глутаматдегидрогеназы и токсинов A/B. Культура мочи была положительной с 50 000 - 99 000 колониеобразующих единиц (КОЕ)/мл Klebsiella pneumoniae. Пациентке назначили цефтриаксон, метронидазол и ванкомицин и выписали через три дня после поступления. В день выписки посев крови был документирован как "отсутствие роста в течение 3 дней". Пациентка посетила своего лечащего врача на следующий день после выписки. Через два дня в кабинет первичного врача поступило уведомление об уточненном заключении. Культура крови пациентки, взятая в день поступления, была исправлена с отсутствия роста на положительную с ростом Fusobacterium nucleatum. С пациенткой связались, чтобы проверить ее состояние, и проверили соблюдение режима приема лекарств. Пациентка продолжала демонстрировать улучшение симптомов при наблюдении в кабинете врача через 10 дней после выписки.
Что же произошло? Культура крови была взята в клинике неотложной помощи. Согласно политике микробиологической лаборатории этой клиники, при получении первого положительного результата на культуру крови, в котором не обнаружено ни одного видимого микроорганизма (no organisms seen - NOS), необходимо провести инокуляцию на соответствующие среды и приготовить три мазка. Один из мазков окрашивается по Граму, и если микроорганизмы не видны, окрашенный и неокрашенный мазки вместе с инокулированной средой отправляются в централизованную микробиологическую лабораторию. Затем флакон должен быть вновь загружен в прибор для культивирования крови.
При повторном положительном сигнале того же флакона с NOS необходимо инокулировать соответствующую среду и приготовить 3 мазка. Один из мазков окрашивается по Граму, и если организмы по-прежнему не видны, окрашенный и неокрашенный мазки отправляются в централизованную лабораторию вместе с положительным флаконом и инокулированной средой. Централизованная лаборатория должна использовать неокрашенный мазок для окрашивания акридиновым оранжевым (АО).
В случае этой пациентки флакон с анаэробной культурой крови из одного набора был признан положительным на 4-й день инкубации. Окраска по Граму была признана NOS, и инокулированные среды и мазки были отправлены в централизованную лабораторию. Флакон был перезагружен в прибор, и в тот же день он второй раз был признан положительным. Из флакона был сделан новый мазок, который был окрашен АО, и он вновь был признан NOS.
В нашей лаборатории, если результат окрашивания по Граму не дополняет данные по культуре крови, она автоматически проверяется как отрицательная культура крови каждые 24 часа с окончательным отрицательным результатом через 5 дней. Оба набора культур крови этой пациентки показали отсутствие роста на 5 день. При считывании культуры через 48 часов (6 дней после взятия) посевы на кровяном и шоколадном агаре не показали роста, но анаэробный агар CDC показал рост. Изолят был идентифицирован методом масс-спектрометрии MALDI и на 99,9% соответствовал Fusobacterium nucleatum.
В соответствии с протоколом был проведен анализ мазков этой противоречивой культуры. Неокрашенный мазок, присланный лабораторией неотложной помощи, не был окрашен AO и не был просмотрен в соответствии с протоколом. Вместо этого, как упоминалось выше, было проведено окрашивание по Граму нового неокрашенного мазка, и он был признан NOS. При просмотре этого мазка, окрашенного АО были обнаружены длинные тонкие флуоресцирующие палочки с сужающимися концами (илл. 1).

Иллюстрация 1. Окраска акридиновым оранжевым.
Мазок, который был отправлен после второго положительного сигнала, но не был окрашен и прочитан, также был окрашен AO, и в нем были видны длинные тонкие флуоресцирующие палочки с коническими концами (илл. 2).
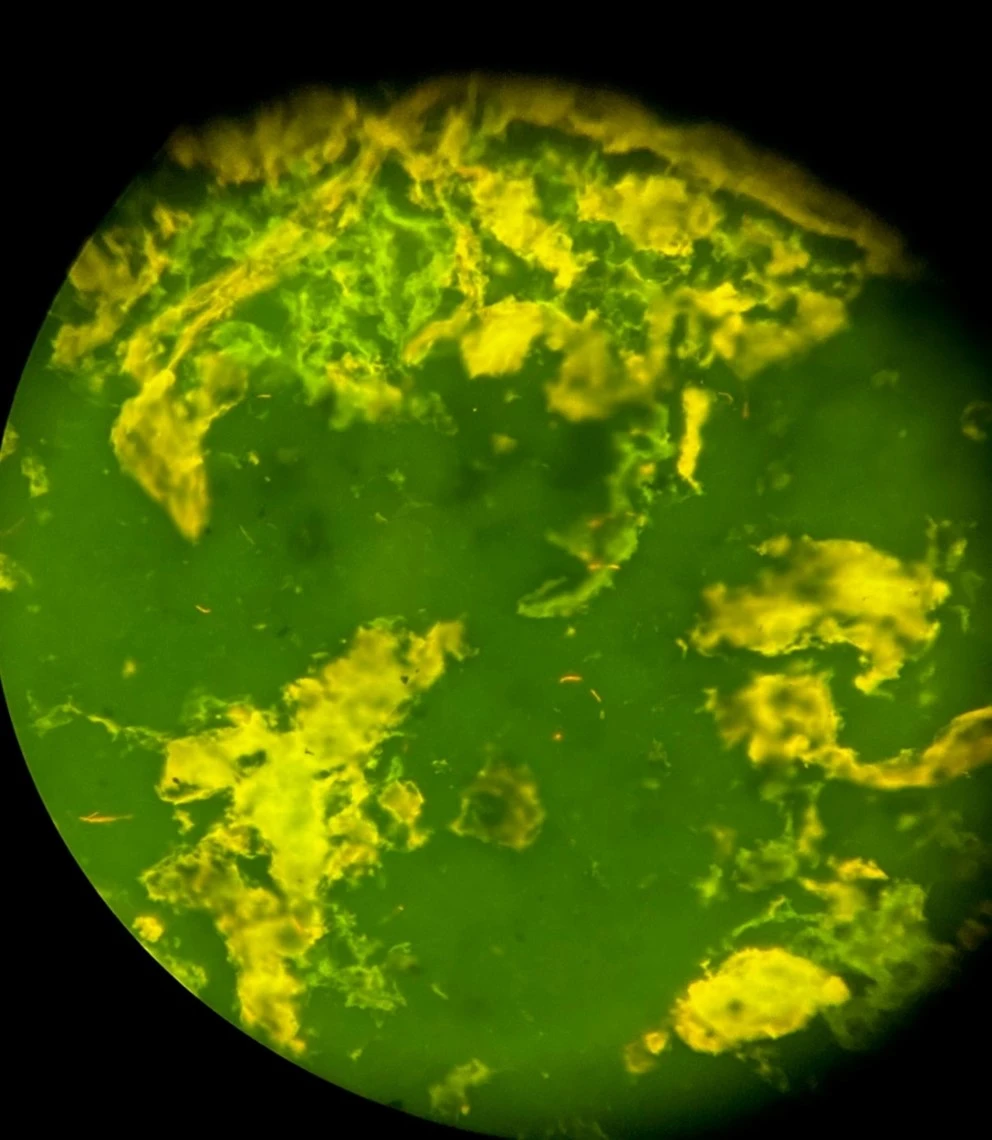
Иллюстрация 2. Окраска акридиновым оранжевым.
На этом этапе исследования также был просмотрен мазок с окраской по Граму из первого положительного флакона, присланное из лаборатории больницы неотложной помощи. Зная, что флакон был положительным на F. nucleatum, бактериолог сообщила, что в итоге увидела редкие длинные тонкие грамотрицательные палочки с заостренными концами, которые совпадали с тем, что было видно при окраске АО (илл. 3).
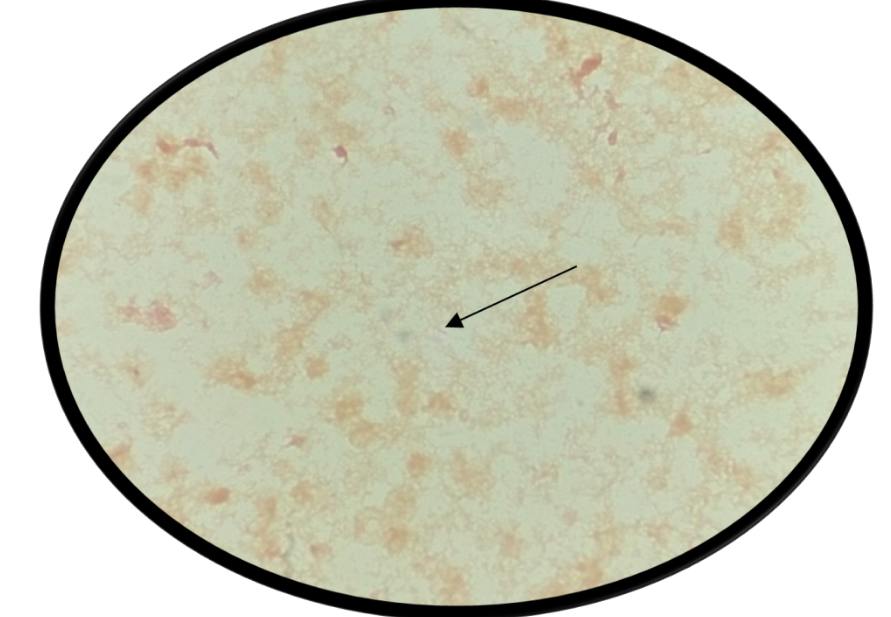
Иллюстрация 3. Окраска по Граму.
При окрашивании еще на 10 минут был добавлен сафранин, что позволило выявить микроорганизм более четко (илл. 4).
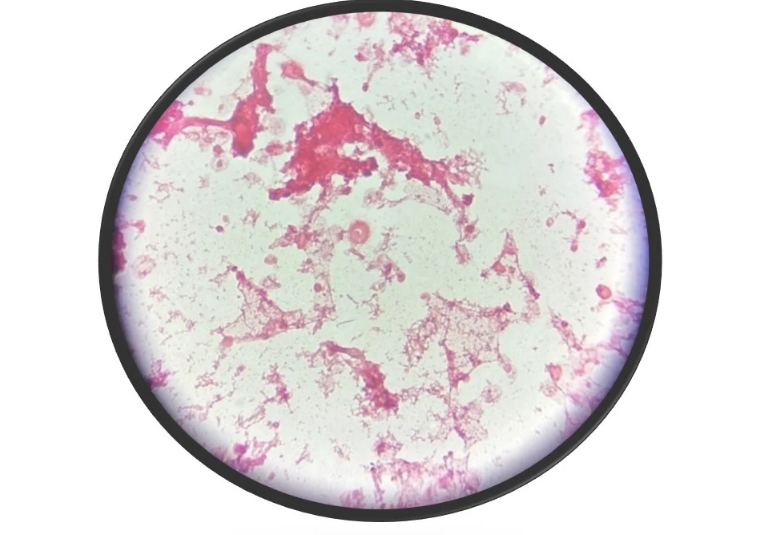
Иллюстрация 4. Окраска по Граму с сафранином.
Обсуждение
Fusobacterium - это облигатные анаэробные грамотрицательные палочки, которые окрашиваются по Граму как светлоокрашенные тонкие палочки с заостренными концами. Fusobacterium встречаются в орофарингеальной флоре и часто встречаются в биопленках полости рта. Это основной возбудитель периимплантита, инфекций корневых каналов, дентоальвеолярных абсцессов и распространяющихся одонтогенных инфекций. Он также может быть возбудителем абсцессов в различных частях тела и попадать в кровоток.
Из-за особенностей окраски видов Fusobacterium они часто сливаются с фоном окраски по Граму при положительных посевах крови. В результате пропуск окрашивания по Граму и задержка роста культуры в сочетании с поздним обнаружением Fusobacterium на приборах для культивирования крови для этих привередливых организмов может привести к ложноотрицательному заключению, которое обнаруживается только после того, как организм вырастает из первоначального флакона с NOS.
Сафранин - это вторичное или контр-окрашивание, используемое при окраске по Граму, которое окрашивает бесцветные грамотрицательные бактерии в розовый или красный цвет. По имеющимся данным, Brucella melitensis, Legionella и Campylobacter усиливают окраску за счет 2-х минутной окраски сафранином, а при подозрении на анаэробы и отсутствии таковых рекомендуется оставить окраску на 3-5 минут или использовать основной фуксин, чтобы усилить морфологию этих микроорганизмов. По этой причине некоторые лаборатории регулярно используют основной фуксин в качестве контр-окрашивания.
Акридиновый оранжевый (АО) - это флуорохроматический краситель, который связывается с нуклеиновыми кислотами микроорганизмов и клеток человека. РНК и одноцепочечная ДНК окрашиваются в оранжевый цвет, а двуцепочечная ДНК, содержащаяся в клетках человека, за исключением эритроцитов, окрашивается в желтый или желто-зеленый цвет при визуализации под ультрафиолетовым светом. Таким образом, бактерии и грибы окрашиваются в ярко-оранжевый цвет, а эпителиальные клетки, лейкоциты и фоновые фрагменты - в бледно-зеленый или желтый. Среди распространенных применений AO - рутинный скрининг обычно стерильных жидкостей организма и исключение грамположительных микроорганизмов на фоне преципитата, окрашенного кристаллическим фиолетовым. Важно отметить, что, несмотря на невозможность дифференцировать реальный микроорганизм, он помогает обнаружить Mycoplasma и Ureaplasma.
Заключение
Слепое субкультивирование NOS, окрашенных по Граму, из положительных культур крови, более длительное окрашивание сафранином и окрашивание AO - все это полезно добавить в арсенал микробиологической лаборатории. Они особенно полезны при включении в протокол исследования стерильных образцов из участков тела, где можно заподозрить наличие организмов, которые окрашиваются слабо и сливаются с фоном.

