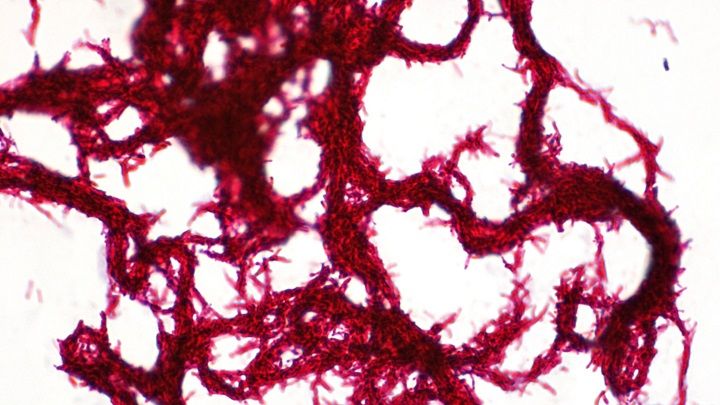
Способность микобактерий туберкулеза (МТБ), вызывающих серьезные респираторные инфекции, образовывать змееподобные нити была впервые отмечена около 80 лет назад.
В работе, опубликованной 20 октября в журнале Cell, исследователи сообщают о биофизических механизмах формирования этих нитей и демонстрируют как несколько поколений делящихся бактерий объединяются для создания таких структур, обеспечивающих резистентность к антибиотикам.
"Наша работа четко показала, что формирование этих биопленкоподобных нитей, "шнуров" или "жгутов" имеет важное значение для развития инфекции и почему эта высокоупорядоченная архитектура может быть важна для патогенеза. Эти структуры являются индикаторами вирулентности", - рассказывает старший автор статьи Вивек Такер с кафедры инфекционных болезней Гейдельбергского университета в Германии.
В исследовании использовалась уникальная комбинация технологий для изучения роли образования шнуров МТБ. Одна из них - модель "легкое на чипе", которая позволила исследователям получить непосредственное представление о "первом контакте" между МТБ и клетками хозяина на границе раздела воздух-жидкость в легких. Это позволило выявить, что образование жгутов происходит на ранних стадиях инфекции. Исследователи также использовали мышиную модель, в которой развиваются патологии, имитирующие туберкулез человека, что позволило получить ткани, которые можно было изучить с помощью конфокальной визуализации, и подтвердить, что образование жгутов также происходит на ранних стадиях инфекции in vivo.
В моделях легких на чипе и мышей шнуры микобактерий в альвеолярных клетках способствуют подавлению сигналов врожденного иммунитета через ядерную компрессию. Затем внеклеточные шнуры вызывают контактно-зависимую гибель фагоцитов, но при этом прорастают между эпителиальными клетками. В результате работы был получен также ряд новых данных о том, как формирование этих жгутов влияет на альвеолы в легких. Исследование также показало, как эти жгуты сохраняют свою структурную целостность и как они повышают резистентность к антибиотикотерапии. Бактерии в шнурах остаются трансляционно активными, несмотря на воздействие антибиотиков, и быстро размножаются после прекращения лечения.
"Растет понимание того, что механические силы влияют на поведение и реакцию клеток, но этот аспект не учитывается, поскольку традиционные модели клеточных культур не воспроизводят механическую среду ткани", - поясняет Такер. "Поэтому понимание того, как силы на клеточном и тканевом уровне или давление на молекулярном уровне влияют на функционирование клеток и тканей, важно для полного представления о работе биосистем. Рассматривая МТБ при инфекции как агрегаты, а не как отдельные бактерии, мы можем понять взаимодействия с белками хозяина для известных эффекторов патогенеза МТБ и построить новую парадигму патогенеза, в которой факторы бактериальной архитектуры влияют на функции хозяина".
Будущие исследования будут направлены на то, чтобы понять, позволяет ли образование жгутов придать новую функциональность известным эффекторам патогенеза МТБ, многие из которых расположены на клеточной стенке МТБ. Кроме того, будет изучено влияние плотной упаковки на бактерии внутри пучка и то, как это влияет на эффективность защиты от антибиотиков.
"Антибиотикотерапия является основным методом лечения туберкулезной инфекции, однако терапевтические схемы длительны и сложны, а угроза лекарственной резистентности возрастает", - говорит Такер. "Существует потребность в терапии, направленной на хозяина, или в терапии, подавляющей специфические механизмы вирулентности, которая может сократить и улучшить антибиотикотерапию".
Данное исследование создает концептуальную основу для биофизики туберкулезной инфекции и воздействия на архитектуру агрегатов МТБ.