Практически сразу после рождения начинается формирование микробных сообществ на теле человека и внутри него.
Поверхность кожи человека сухая, соленая и представляет собой среду с низким уровнем pH (~5), состоящую из мертвых клеток кожи - кератиноцитов. Воздействия внешней среды счищают отмершие клетки кожи и, как следствие, микробиота кожи не живет на внешней поверхности кожи. Микроорганизмы живут под мертвыми клетками, под слоем отмирающих клеток и внутри слоя еще живых кератиноцитов. Понимание того, как наша иммунная система реагирует на эту миграцию, - давний вопрос, но его изучением исследователи начали заниматься лишь недавно.
Отношения между микроорганизмами и человеком часто рассматриваются двояко: либо как патогенные захватчики, либо как дружественные симбионты. Предыдущие иммунологические исследования были сосредоточены на первых отношениях, но сейчас исследователи понимают, что большинство микробов, с которыми сталкивается наша иммунная система, являются членами нашего микробиома, а не патогенами. Такое взаимодействие приводит к тому, что в коже здорового человека присутствует более 20 миллиардов лимфоцитов, чьи микробные мишени неизвестны. Предположительно, эти лимфоциты реагируют на микробиоту кожи, но как они узнают, какие микробы являются друзьями, а какие - врагами?
Понимание взаимодействия между Т-клеточными лимфоцитами и комменсальными микроорганизмами является краеугольным камнем исследований Ясмин Белкайд из Национального института здоровья США. В центре ее внимания - влияние микробиома кожи на иммунную систему в здоровом состоянии, и она обнаружила взаимосвязь, которая повышает адаптивность и функцию иммунитета.
Видным членом микробиома здоровой кожи и объектом исследования Белкайд является грамположительная бактерия Staphylococcus epidermidis (S. epi). После попадания S. epi в кожу дендритные клетки (лимфоциты), находящиеся в коже, собирают образцы множества белков и молекул, выделяемых S. epi. Затем дендритные клетки мигрируют в лимфатические узлы, где находятся другие лимфоциты.
Чтобы сообщить о типе присутствующего патогена и вызвать соответствующий ответ, из образца выбираются чужеродные пептиды, обрабатываются, а затем презентируются наивным Т-клеткам дендритными клетками с помощью белков главного комплекса гистосовместимости (MHC). В контексте бактериальных патогенов используются MHC класса II, и образующиеся комплексы пептид-MHC II распознаются CD4 Т-клетками. Если бы это был вирусный или внутриклеточный бактериальный патоген, выбранный и обработанный пептид был бы представлен на белках MHC класса I, что привлекло бы CD8 Т-клетки.
Однако исследования Белкайд на мышах показали, что пептиды комменсальных бактерий, таких как S.epi, вместо этого представлены с помощью "неклассических" белков MHC класса I, которые рекрутируют и обучают CD8 Т-клетки. Гены, кодирующие эти "неклассические" белки MHC, сохранились с момента разделения линий мыши и человека, около 50 миллионов лет назад, в то время как "классические" гены MHC I с тех пор значительно эволюционировали. Это говорит о древних отношениях между комменсалами и иммунными системами мышей и человека, которые значительно отличаются от современных отношений с патогенами.
Как только Т-клетка обучается следовать определенному пути воспаления, она, как правило, не может вызывать другие реакции воспаления. Например, CD8 Т-клетка, "обученная" выделять IFNg, который активирует механизм JAK-STAT, не может быть "переучена" на выделение IL-17A для активации механизма NF-kB, каждый из которых имеет различные результаты воспаления.
Удивительно, но исследование Белкайд показало, что специфичные к комменсалам CD8 Т-клетки могут переключаться с первоначального воспалительного ответа на другой в присутствии бактерий и воспалительных цитокинов, что является необычной особенностью для Т-клеток, нацеленных на антиген. Таким образом, после активации и обучения специфические к S.epi CD8 Т-клетки мигрируют в кожу и патрулируют слой кожи под кератиноцитами, где они обладают способностью гибко реагировать на повреждение ткани (см.иллюстрацию ниже).
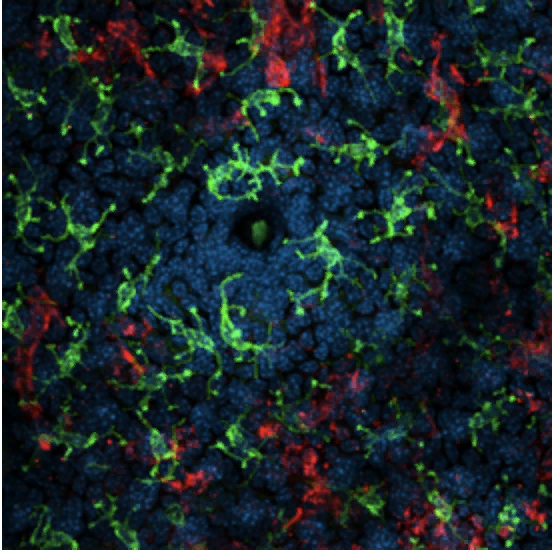
Иммунные клетки (ярко-зеленые) патрулируют вокруг волосяного фолликула (черный круг вокруг зеленого центра).
Точная роль этих специфических к S.epi Т-клеток в коже до конца не ясна. Однако исследования Белкайд показали, что эти Т-клетки экспрессируют больше генов, связанных с восстановлением тканей. Этот фактор может повысить способность S.epi специфических Т-клеток, кератиноцитов и S.epi работать согласованно и защищать кожу от инвазивных патогенов (например, S. aureus), рака и способствовать заживлению ран.
Живые кератиноциты вырабатывают отрицательно заряженные антимикробные пептиды, с которыми S.epi справляется благодаря своей положительно заряженной клеточной стенке. Эта адаптация позволяет S.epi занять свою нишу в кожной среде, которую они защищают, производя свой собственный набор антимикробных веществ. Например, S.epi вырабатывает протеазу Esp, которая разрушает поверхностные белки S. aureus, предотвращая адгезию, и молекулу 6-HAP, которая препятствует репликации ДНК бактерий и клеток кожи. Кератиноциты вырабатывают большое количество анти-6-HAP ферментов для своей защиты, а опухолевые клетки кожи - нет, поэтому 6-HAP защищает от опухолевых клеток.
Еще одна интересная особенность заключается в том, что при повреждении кожи все встает на свои места. Продукты клеточной стенки бактерий обычно вызывают воспаление. Но в ранах кожи продукты клеточной стенки S.epi вместо этого гасят воспалительные сигналы кератиноцитов, возникающие при обнаружении поврежденных клеток хозяина. Специфические для S.epi Т-клетки чувствуют, что в коже есть повреждение, и мигрируют в это место, где их присутствие ускоряет заживление раны.
За предыдущие десятилетия иммунологических исследований был разработан целый ряд инструментов и методов, позволяющих выяснить, как наша иммунная система защищается от вторжения микробов. Теперь иммунологи новой генерации, включая Белкайд, используют эти методы, чтобы выяснить, как наша иммунная система взаимодействует с членами нашего микробиома. Полученные данные свидетельствуют о древней связи между млекопитающими и микроорганизмами, которая защищает от патогенов, рака и ускоряет заживление ран. Белкайд считает, что подобные исследования могут привести к разработке методов манипулирования микробиотой кожи для улучшения здоровья кожи в различных областях - от лечения ран до рака.