Подобно тому, как люди создают горы мусора, наши клетки постоянно выбрасывают белки, которые повреждены или больше не нужны.
Клеточные утилизаторы, называемые протеасомами, наиболее известны своей центральной ролью в деградации и переработке белков, но еще в 1990-х годах было показано, что продукты этого процесса - короткие пептиды, - могут отображаться на поверхности клеток, помогая иммунной системе распознавать угрозы.
В новом исследовании, опубликованном 5 марта в журнале Nature, сотрудники лаборатории профессора Ифата Мербла из Научного института Вейцмана (Израиль) сообщают о раскрытии удивительного иммунного механизма, связанного с протеасомами. Авторы обнаружили, что некоторые пептиды, выделяемые протеасомой в процессе расщепления белков, способны убивать бактерий. Эти открытия расширяют наши представления о врожденных защитных механизмах организма и дают новую надежду на борьбу с растущей угрозой устойчивости к антибиотикам.
Несколько лет назад ученые из лаборатории Мербла разработали инновационную технологию, которая позволила им «нырять в мусорное ведро» внутри протеасомы - сложной молекулярной машины, состоящей из множества белков. Используя этот передовой метод, исследователи отслеживали протеасомы при различных заболеваниях, таких как волчанка и рак, накапливая огромное количество данных о деградирующих белковых фрагментах.
"Мы проанализировали все данные и задались вопросом: «Могут ли продукты деградации протеасом играть какую-то дополнительную роль, помимо того, что они презентируются иммунной системе?» - рассказал Мербл об отправной точке нового исследования. К своему удивлению, исследователи обнаружили, что многие из этих продуктов деградации совпадают с последовательностями, ранее идентифицированными как антимикробные пептиды - важнейшие компоненты врожденной иммунной системы, которые выступают в качестве первой линии защиты организма от бактерий, вирусов и паразитов.
В течение многих лет было известно, что такие пептиды могут генерироваться ферментами, разрезающими белки (протеазами), которые «высвобождают», чтобы они могли стать активными, но новые результаты, полученные в лаборатории Мербла, показали, что такие пептиды могут активироваться протеасомами. Более того, исследование показало, что протеасома сама постоянно производит эти пептиды в рамках своей рутинной деятельности и что это производство значительно увеличивается во время бактериальных инфекций. «До сих пор мы ничего не знали о связи между продуктами протеасомы и производством этих пептидов», - говорит Мербл. «В свете полученных результатов мы провели обширную серию экспериментов, доказывающих, что протеасомы являются ключевым звеном в этой защитной системе».
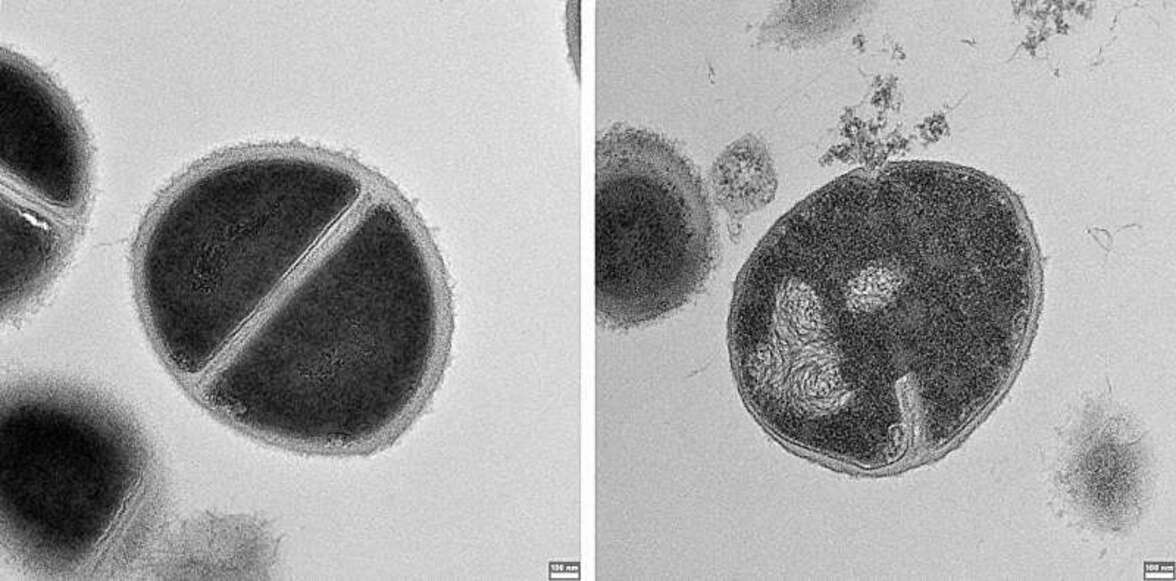
В одном из экспериментов, проведенном на человеческих клетках, исследователи ингибировали протеасомы в одной группе клеток и оставили их нетронутыми в другой; когда клетки были заражены сальмонеллами, вторгшиеся бактерии процветали в группе, в которой отсутствовали активные протеасомы. В другом эксперименте бактерии процветали, когда протеасома функционировала нормально, но вырабатываемые ею пептиды разрушались. Эффективность пептидов также была продемонстрирована на мышах, инфицированных стафилококками. Эксперименты показали, что воздействие пептида, полученного из протеасомы, значительно сократило количество бактерий, уменьшило повреждение тканей и даже улучшило показатели выживаемости.
Результаты удивили исследователей по двум причинам. Во-первых, они показали, что один пептид, который естественным образом вырабатывается организмом, может оказаться эффективным средством против опасного для жизни заболевания при введении его в больших количествах. Во-вторых, результаты лечения были сопоставимы с результатами лечения сильными антибиотиками, используемыми в клинической практике. Но больше всего исследователи обрадовались, когда поняли, что бактериальная инфекция переводит протеасому в «турбо-режим». Мы увидели, что инфекция заставляет протеасому изменять свой режим резки белков, «благоприятствуя» производству пептидов с антибактериальными свойствами», - объясняет Мербл.
Когда ученые попытались объяснить, чем вызвано это обстоятельство, то уже через час после инфицирования они выявили протеасомы с контрольной единицей под названием PSME3 и обнаружили, что эта субъединица отвечает за приоритетное производство таких пептидов. Когда они запретили протеасомам использовать эту контрольную субъединицу, бактерии были менее повреждены, что подчеркивает важность протеасом в обеспечении первой линии защиты от инфекции. «Возможность отслеживать, как меняется активность протеасом в ответ на бактериальную инфекцию, была основана на технологии, которую мы разработали несколько лет назад», - объясняет Мербл.
«Поворотный момент наступил, когда мы увидели, что активность протеасомы по разрезанию пептидов меняется во время инфекции. Тогда мы поняли, что открыли ранее неизвестный иммунный механизм».
Затем исследователи задались более широким вопросом: сколько еще не известных антимикробных пептидов может скрываться в человеческих белках? Используя алгоритм для анализа всех белков, производимых человеческим организмом, они выявили пептиды с потенциальными антибактериальными свойствами в 92% человеческих белков. Моделирование выявило более 270 000 ранее неизвестных пептидов, которые могут высвобождаться протеасомами, представляя собой огромный неиспользованный резервуар природных антимикробных агентов. "Эта база данных пептидов открывает новые горизонты для разработки персонализированных методов лечения инфекций и других заболеваний", - отмечает Мербл. Например, природные пептиды могут быть адаптированы для укрепления иммунной защиты у пациентов с ослабленным иммунитетом, таких как реципиенты трансплантатов органов или больные раком.
Кроме того, поскольку резистентность к антибиотикам продолжает представлять собой серьезную проблему для здравоохранения, результаты исследования не только пересматривают наше понимание клеточного иммунитета, но и прокладывают путь к инновационным методам лечения, основанным на естественных механизмах. Помимо клинических последствий, Мербл отмечает, что наибольшее волнение вызвало открытие фундаментального клеточного механизма, который регулируется протеасомами и отличается от всех ранее известных. «Это исследование показывает, как технологические инновации и фундаментальные исследования переплетаются непредвиденным образом. Без технологии, которая позволила нам анализировать клеточный "мусор", мы бы не сделали этого открытия, и когда мы разрабатывали эту технологию, мы и представить себе не могли, что откроем новый иммунный механизм».