В качестве альтернативы антибиотикам антимикробные пептиды (AMП) находятся на переднем крае международных усилий, поскольку они с меньшей вероятностью вызывают резистентность бактерий.
AMП представляют собой разнообразную группу встречающихся в природе пептидов системы врожденной защиты с активностью против различных патогенов, таких как дрожжи, грибы, вирусы и бактерии. Для инактивации этих патогенов AMП проявляют многоцелевое, неспецифическое и быстрое действие, что приводит к медленному или ограниченному возникновению резистентности (Wimley and Hristova, 2011). Кроме того, некоторые AMП проявляют синергическое взаимодействие с обычными антибиотиками, что может снизить селекцию резистентных к антибиотикам бактерий (Steenbergen et al., 2009; Wu et al., 2020).
Примерно одновременно с открытием первого антибиотика пенициллина в 1928 году, в молоке был обнаружен первый АМП низин. Этот AMП был одобрен FDA США в качестве пищевого консерванта в 1988 году благодаря своей термостабильности и устойчивости к низкому pH. После открытия низина, из бактерий, грибов, растений, беспозвоночных и позвоночных животных было выделено несколько других AMП, таких как грамицидин, тироцидин, аламетицин, пуротионин и дефенсины. Однако клиническое применение AMП в качестве противомикробных препаратов было ограничено из-за соображений токсичности и других проблем, таких как высокая стоимость производства по сравнению с антибиотиками.
Возобновление интереса к АМП в связи с ростом числа антибиотикоустойчивых и толерантных бактерий привело к тому, что в 1955 году FDA одобрило грамицидин и полимиксин В в качестве компонентов препарата Neosporin®, в 1962 году - колистин (полимиксин Е), а в 2003 году - даптомицин. Несколько природных и синтетических AMП были клинически исследованы для борьбы с патогенными бактериями, но после одобрения даптомицина ни один новый АМП не был одобрен в качестве противомикробного препарата.
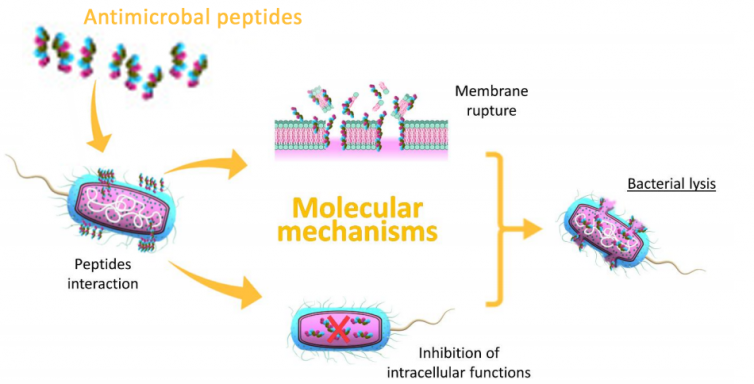
АМП также проявляют иммуномодулирующие свойства - от модуляции воспалительных реакций до содействия заживлению ран. Что еще более интересно, АМП вызывают разрушение клеток за счет неспецифических взаимодействий с поверхностью мембраны патогенов. Это, скорее всего, и является причиной низкой или ограниченной устойчивости бактерий ко многим АМП. Несмотря на растущее число антибиотикорезистентных бактерий и потенциал новых АМП для борьбы с такими патогенами, лишь немногие АМП используются в клинической практике.
Поэтому в настоящем обзоре описываются (i) потенциал АМП как альтернативы антибиотикам, (ii) проблемы клинического применения АМП и (iii) стратегии повышения успешности АМП в клинических испытаниях с акцентом на уроки, которые мы могли бы извлечь из этих испытаний.
АМП демонстрируют явные преимущества перед обычными антибиотиками в борьбе с различными инфекционными заболеваниями. В частности:
(i) их широкий спектр активности,
(ii) многоцелевой, неспецифический и быстрый способ действия, который приводит к ограниченному возникновению резистентности,
(iii) потенциальные иммуномодулирующие свойства и
(iv) синергетическое взаимодействие с обычными антибиотиками могут устранить угрозу MDR бактерий.
Тем не менее, до сих пор лишь несколько АМП (например, низин, грамицидин, полимиксины, даптомицин и мелиттин) достигли клиники. Проблемы клинического применения АМП включают цитотоксическое действие, стоимость производства, а также проблемы, связанные с биодоступностью и эффективностью пептидов. Для преодоления этих проблем было разработано несколько стратегий, таких как получение ультракоротких AMП, системы доставки, химические модификации и тщательный выбор противоиона на последнем этапе синтеза AMП. Хотя не все АМП, находящиеся в клинической разработке, выйдут на рынок, эти стратегии могут повысить процент успеха АМП в клинических испытаниях. Тем не менее, несколько АМП в клинических испытаниях потерпели неудачу из-за отсутствия явной эффективности или превосходства над обычными антибиотиками, хотя и показали тенденцию к улучшению клинических результатов.
Поэтому в будущих клинических испытаниях АМП следует также учитывать практические стратегии, поскольку были извлечены следующие уроки:
(1) Применение АМП может выходить за рамки утвержденных FDA клинических показаний;
(2) Определение наиболее оптимальной дозы и режима применения может снизить цитотоксическое действие АМП;
(3) Эффективность АМП может быть продемонстрирована в испытаниях на эквивалентность или неравноценность с использованием антибиотика в качестве компаратора;
(4) Развитие бактериальной резистентности должно быть включено в качестве одного из параметров первичного результата в клинических испытаниях АМП;
(5) Биодоступность и эффективность АМП могут быть улучшены с помощью систем доставки и,
(6) Комбинация АМП с обычными антибиотиками или другими соединениями (другими АМП) может привести к улучшению противомикробного эффекта в клинических испытаниях.
Учитывая эти уроки, все большее число АМП может выйти на рынок в качестве многофункциональных, мощных и длительно действующих антимикробных препаратов против различных инфекционных заболеваний.