Азитромицин (AZM)
- это 15-членный кольцевой макролид, обладающий антимикробной активностью широкого спектра действия в отношении грамположительных бактерий и атипичных микроорганизмов, но имеющий слабую диффузию во внешнюю мембрану грамотрицательных бацилл, включая Pseudomonas aeruginosa (PA). Тем не менее, AZM продемонстрировал клинические преимущества у пациентов, страдающих хроническими респираторными инфекциями, вызываемыми PA, особенно у пациентов, страдающих муковисцидозом. Поскольку рост полирезистентности РА привел к растущей потребности в новых терапевтических возможностях, этот макролид был предложен в качестве дополнительной терапии.
Клинические исследования, оценивающие применение AZM при острой PA-ассоциированной пневмонии, скудны. Однако тщательное изучение имеющейся литературы дает хорошие основания для ее использования в этом контексте. Фактически, 14- и 15-членные макролиды продемонстрировали иммуномодулирующие и иммуносупрессивные эффекты, которые могут представлять большой интерес при лечении острых форм заболевания.
Кроме того, растущее количество данных подтверждает снижение уровня вирулентности PA, зависящего от прямого взаимодействия с рибосомами, и основанного на модуляции нескольких ключевых регуляторов сети Quorum Sensing (QS) («чувством кворума» называют способность некоторых микроорганизмов к общению посредством специфических сигнальных молекул, необходимому для координации действий членов сообщества. Цит. по Биомолекула). Впервые выявленные in vitro, эти интересные свойства AZM были впоследствии подтверждены на моделях животных. В этом обзоре мы систематически проанализировали литературу, касающуюся иммуномодулирующего и антиPA эффектов AZM. Исследования in vitro и in vivo, а также клинические испытания были проанализированы в поисках обоснований для использования AZM при острой PA -ассоциированной пневмонии.
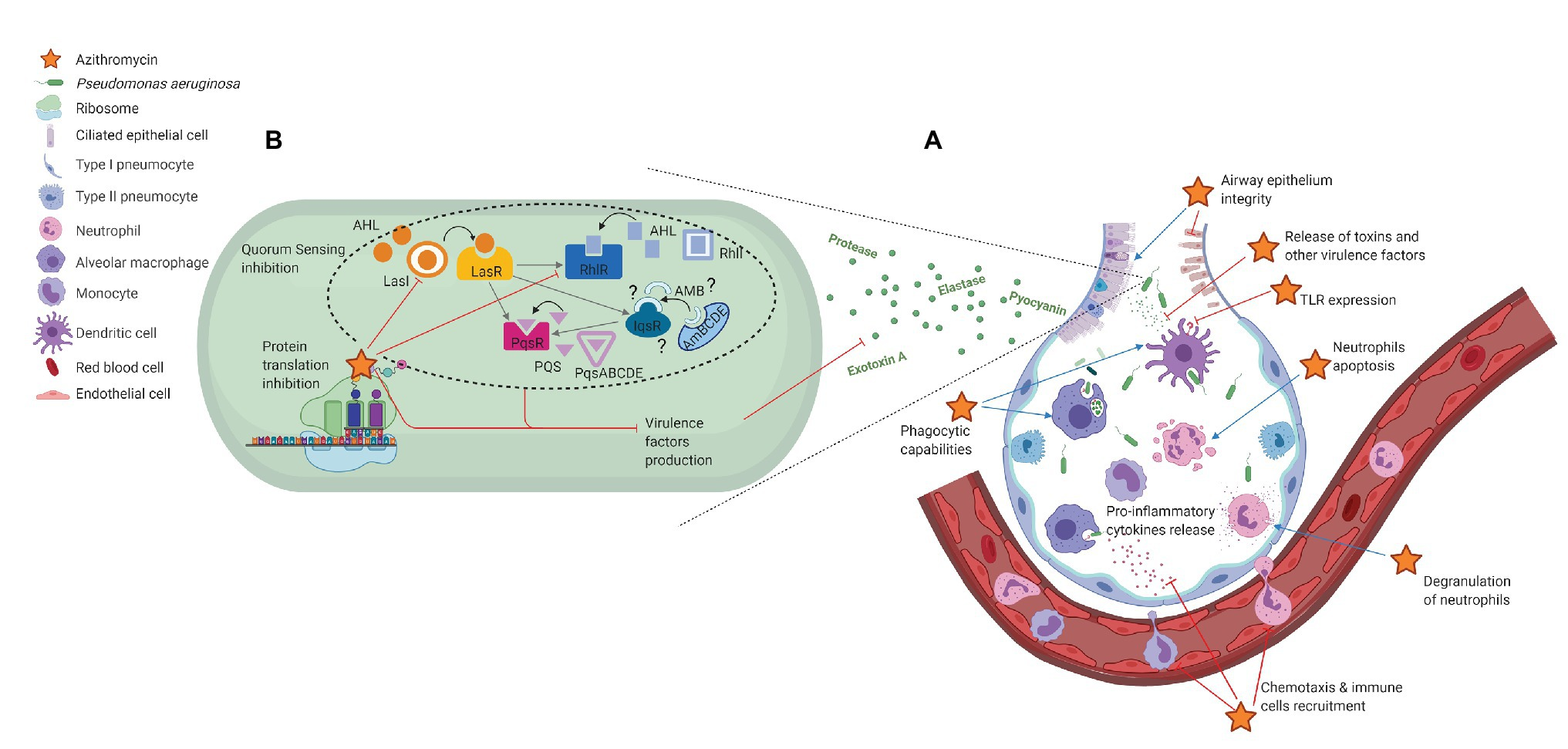
Рис.1. Неантибиотические эффекты азитромицина при острой пневмонии Pseudomonas aeruginosa. A) иммуномодулирующие эффекты; B) снижение вирулентности P. aeruginosa. Эффекты азитромицина проявляются в виде торможения (красный) или стимуляции (синий).
Рассмотренные данные показывают, что AZM, вмешиваясь в сигнальные пути иммунных клеток, модулирует различные стадии иммунного ответа и обладает интересными противовоспалительными и иммуномодулирующими свойствами. Кроме того, этот макролид регулирует экспрессию многочисленных факторов вирулентности PA через связывание рибосом и взаимодействие с сетью QS PA. Эти неантибиотические эффекты, схематично представленные на рис. 1, делают AZM хорошим кандидатом для лечения PA-ассоциированной острой пневмонии. Однако, данный обзор литературы также подчеркивает, что для подтверждения полезности применения AZM при РА необходимы дальнейшие эксперименты in vivo и проспективные контролируемые исследования.
Поскольку AZM не обладает серьезной прямой антимикробной активностью в отношении РА, использование этой молекулы в лечении РА-пневмонии может рассматриваться только как дополнительная терапия, и следует также помнить о риске взаимодействия лекарственных средств. С одной стороны, недавние работы предупреждают о потенциальном антагонистическом эффекте AZM на терапевтические преимущества, предоставляемые тобрамицином при муковисцидозе у пациентов с инфекциями дыхательных путей, вызванными РА (Nick et al., 2014; Klingel et al., 2019). С другой стороны, синергизм между ингибиторами QS и антибиотиками был обозначен в нескольких исследованиях in vitro, и прокладывает путь для новых экспериментов, сочетающих AZM и анти-РА антибиотики (Vadekeetil и др., 2016; Bahari и др., 2017; Roudashti и др., 2017).
Также, воздействие AZM может оказать влияние на микробиом человека, с положительными и отрицательными последствиями, которые нельзя игнорировать. Действительно, появляются свидетельства того, что микробиом легких оказывает значительное влияние на формирование иммунного ответа хозяина и на воспаление легких (Segal et al., 2013, 2016; Roquilly et al., 2019). Недавно было продемонстрировано, что AZM модулирует как легочную микробиоту, так и метаболом, увеличивая тем самым производство противовоспалительных бактериальных метаболитов (Segal et al., 2017). Если модуляция легочного микробиома оказалась эффективной в данном исследовании, то не следует недооценивать неблагоприятное воздействие на микробиоту.
На самом деле, длительная низкодозированная терапия макролидами у пациентов с бронхоэктазами связана со значительными изменениями в ротоглоточной микробиоте, а также со значительным повышением резистентности к трансмиссивным макролидам (Choo et al., 2018). Кроме того, недавно были описаны мутации рибосом в РА у пациентов с муковисцидозом, подвергавшихся длительному воздействию макролидов, что свидетельствует о приобретенной резистентности к антивирулентным эффектам (Mustafa et al., 2017). Было также показано, что одного макролидного курса достаточно для устойчивого изменения микробиоты кишечника мыши (Ruiz et al., 2017).
Таким образом, использование дополнительного антибиотика в качестве дополнительной терапии следует с осторожностью рассматривать в эпоху антибиотикорезистентности и антимикробного управления. Последние достижения в области высокопроизводительных омических подходов должны помочь понять механизм и степень действия AZM и могут привести к рациональному проектированию более эффективных методов лечения.