Начался набор участников в клиническое испытание ранней стадии, оценивающее терапию бактериофагами у взрослых больных муковисцидозом (МВ), которые являются носителями Pseudomonas aeruginosa (P. aeruginosa) в своих легких.
В ходе испытания выяснится, насколько бактериофаги, или "фаги", безопасны и способны уменьшить количество бактерий в легких добровольцев. Испытание проводится группой Antibacterial Resistance Leadership Group (ARLG), финансируемой Национальным институтом аллергии и инфекционных заболеваний (NIAID) США. Исследователи планируют привлечь до 72 взрослых в 16 центрах МВ по всей территории США.
Уже более века исследователи рассматривают возможность использования фагов в качестве терапевтических средств, предполагая, что смеси бактериофагов могут быть использованы самостоятельно или в сочетании с антибиотиками для лечения бактериальных инфекций, особенно резистентных к антибиотикам.
P. aeruginosa, серьезная и иногда смертельно опасная бактерия, часто приобретаемая в медицинских учреждениях, является наиболее распространенной бактериальной причиной обострений МВ. P. aeruginosa может воспользоваться повреждением тканей, вызванным изменениями в слизи при МВ, чтобы инфицировать и колонизировать легкие. Инфекции P. aeruginosa с множественной лекарственной резистентностью становятся все более распространенными, и в последние годы для их лечения было одобрено лишь несколько новых антибиотиков.
"Распространенность резистентности к антибиотикам вызывает беспокойство, и особенно остро ощущается потребность в более эффективных терапевтических средствах для уязвимых групп населения, таких как пациенты с муковисцидозом", - отметил директор NIAID Энтони С. Фаучи. "Хотя исследования бактериофаговой терапии, возможно, все еще находятся в зачаточном состоянии в США, мы надеемся, что это исследование и другие подобные ему могут открыть двери для нового вида терапии трудноизлечимых бактериальных инфекций".
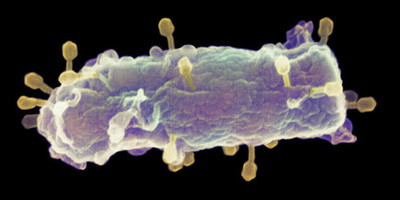
Экспериментальный фаговый терапевтический препарат WRAIR-PAM-CF1 производится компанией Adaptive Phage Therapeutics. Он содержит коктейль из четырех видов бактериофагов, которые естественным образом инфицируют P. aeruginosa и захватывают ее клеточные функции, уничтожая при этом бактерию. Фаги в составе коктейля высокоспецифичны и не атакуют клетки человека. Они были выращены, очищены и тщательно изучены в лабораторных условиях. Генетический анализ этих фагов показал, что они не несут вредных генов, которые могут случайно передаться бактериям, которых они инфицируют, например, генов, которые могут придать резистентность к антибиотикам.
В исследование будут включены пациенты с МВ, у которых в дыхательных путях хронически присутствует P. aeruginosa. Участники будут получать фаговый коктейль в виде однократной внутривенной инфузии в одной из трех дозировок. Исследователи будут собирать данные о безопасности и микробиологической активности; о том, как фаги функционируют в организме; как коктейль влияет на функцию легких участников; действует ли терапия по-разному на P. aeruginosa из разных географических регионов; и изменяет ли терапия общее качество жизни участников.
Исследование начнется как испытание фазы 1b, а затем будет расширено до фазы 2. Сначала двум участникам с каждой дозировкой будет проведена инфузия терапевтического препарата, после чего в течение четырех дней за ними будет вестись тщательное наблюдение. Если не будет выявлено серьезных проблем с безопасностью, исследователи начнут набирать дополнительных участников, которые будут рандомизированы для получения однократной инфузии терапевтического препарата в одной из трех дозировок или инфузии плацебо.
Эта часть исследования будет проходить в режиме двойного слепого наблюдения, поэтому ни участники, ни исследователи не будут знать, кто получает плацебо. Оценка безопасности и микробиологического воздействия терапии будет проведена после того, как восемь участников примут каждую дозу. Результаты этой оценки определят, какая дозировка будет применяться на следующем этапе исследования.
В испытании фазы 2 примут участие до 50 человек, которые будут рандомизированы для получения выбранной дозы фагового коктейля или плацебо. Каждый доброволец совершит несколько контрольных визитов для наблюдения за состоянием здоровья и реакцией на экспериментальную терапию.