Появление резистентных к антибиотикам патогенных микроорганизмов значительно опережает процесс открытия новых антибиотиков для борьбы с ними.
Отчасти это объясняется тем, что усилия по поиску антибиотиков обычно направлены на скрининг культивируемых микроорганизмов окружающей среды (например, бактерий из почвы) на предмет наличия в них антимикробных соединений. Однако большинство экологических микроорганизмов невозможно вырастить в лаборатории, и поэтому они бесполезны с точки зрения поиска лекарств. С помощью хитроумных методов культивирования ученые получают доступ к некогда недоступным бактериям и открывают на их основе целый ряд новых антибиотиков.
Было время, когда казалось, что антибиотики открывали направо и налево. Этот "золотой век" открытия антибиотиков начался в 1940-х годах, когда Селман Ваксман, лауреат Нобелевской премии, микробиолог, открыл антибиотик широкого спектра действия стрептомицин, полученный из одного из видов почвенных актиномицетов. Открытие Ваксмана указало на то, что почвенные актиномицеты являются потенциальными источниками новых антибиотиков, и побудило фармацевтическую промышленность заняться поиском перспективных бактерий.

Актиномицеты. Фото: Oregon Caves/Wikimedia Commons
Эти усилия привели к открытию многих основных классов антибиотиков, используемых в настоящее время (например, аминогликозидов, тетрациклинов, β-лактамов и т.д.). Однако в 1960-х годах прогресс в этой области приостановился. У почвенных актиномицетов закончились новые антибиотики, которые можно было обнаружить с помощью стандартных методов скрининга. Последующие скрининги синтетических антимикробных препаратов также были в основном безуспешны: большинство синтетических молекул не способны преодолеть клеточную мембрану бактерий (особенно отталкивающие заряды и насосы внешней мембраны у грамотрицательных бактерий) и поэтому неэффективны.
С тех пор прогресс в области открытия антибиотиков был незначительным - или, как сказал на конференции ASM Microbe 2023 Ким Льюис, директор Центра открытия антимикробных препаратов при Северо-Восточном университете США, "мы находимся не в лучшем положении". Однако еще не все потеряно. По мнению Льюиса и его коллег, ключ к ускоренному открытию натуральных продуктов лежит там, куда ученые еще не заглядывали. "Одно из простых предложений - начать поиск не только среди актиномицетов и посмотреть, что мы сможем найти", - говорит Льюис. "А если вы выходите за пределы актиномицетов, то почему бы не выбрать в качестве мишени некультивируемые бактерии?"
Культивировать некультивируемое
Только 1% экологических бактерий может расти на чашке Петри, а 99% остаются некультивируемыми. Большинство этих бактерий невозможно вырастить в лаборатории с помощью традиционных методов культивирования; если ученые не могут их вырастить, они не могут получить доступ к их потенциально полезным продуктам. Однако за последние 20 с лишним лет Льюис и его сотрудники разработали методы культивирования некультивируемых почвенных микробов. Суть метода, по словам Льюиса, заключается в том, чтобы заставить микроорганизмы чувствовать себя как дома, т.е. "обмануть" клетки, заставив их думать, что они растут в своей естественной среде, где у них есть доступ к питательным веществам и другим факторам роста. Вместе со своим коллегой Славой Эпштейном, профессором биологии Северо-Восточного университета, Льюис изобрел, как он в шутку сказал, "очень сложное устройство".
Устройство состоит из полупроницаемой мембраны, пропитанной смесью агара и клеток окружающей среды (т.е. разбавленного образца почвы), помещенной между двумя металлическими шайбами. Сэндвич может быть размещен на открытой площадке для отбора проб или в имитируемой естественной среде в лаборатории. Мембрана позволяет молекулам из окружающей среды диффундировать внутрь и наружу. После инкубации в течение нескольких недель бактериальные микроколонии заселяют мембрану и могут быть выделены. Примечательно, что после создания клеточной популяции бактерии охотнее растут на чашке Петри в лаборатории (восстановление роста достигает 40%). Другой вариант технологии, известный как Isolation Chip (ichip), состоит из сотен крошечных диффузионных камер, вмещающих примерно по 1 бактериальной клетке, что позволяет упростить процесс и выращивать, и изолировать отдельные бактерии.
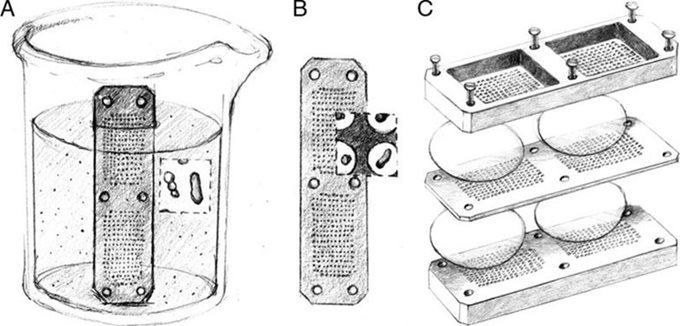
Схематическое изображение ichip. Для сборки устройства пластина с крошечными отверстиями погружается в суспензию клеток окружающей среды, покрывается мембраной и запечатывается между двумя дополнительными пластинами. Иллюстрация: Nichols D., et al/Applied and Environmental Microbiology, 2010.
NovoBiotic Pharmaceuticals - биотехнологическая компания, соучредителями которой являются Льюис и Эпштейн и которая занимается открытием и разработкой новых лекарственных препаратов из природных источников, - использовала технологию диффузионной камеры для скрининга образцов почвы в промышленных масштабах. В настоящее время компания располагает коллекцией из более чем 64 000 некультивируемых бактериальных изолятов и на основе этих необычных изолятов выявила несколько перспективных антибиотиков.
Антибиотики из некультивируемых бактерий
Ведущий антибиотик компании, теиксобактин, был выделен из ранее некультивируемой почвенной бактерии Eleftheria terrae. Льюис подчеркивает, что это соединение проявляет отличную активность против множества грамположительных патогенов, независимо от их антибиотикорезистентности, нетоксично для эукариотических клеток и, судя по имеющимся данным, уничтожает патогены без проявления резистентности. Вероятно, это связано с тем, что мишени теиксобактина на клеточной мембране (липид II и липид III - предшественники пептидогликана и тейхоевой кислоты, соответственно) неизменны. То есть они не являются белками (т.е. не кодируются непосредственно генами), а значит, не приобретают генетических мутаций, способных придать антибиотику резистентность.
Это открытие говорит о том, что "парадигма, согласно которой бактерии всегда и ко всему будут развивать резистентность, неверна", - отмечает Льюис.
Эффективность теиксобактина также связана с его уникальным двухсторонним механизмом действия. Молекулы теиксобактина не только связываются с мишенью, что приводит к ингибированию синтеза клеточной стенки, но и объединяются в надмолекулярные структуры, напоминающие листки. "Мембрана истончается под надмолекулярной структурой", - пояснил Льюис. "Мы решили, что это может привести к нарушению мембраны, и это произошло". Он подчеркнул, что "теиксобактин дает нам рецепт, как разработать безопасные мембраноактивные соединения", которые до сих пор остаются несколько неуловимыми, несмотря на все усилия ученых найти их. С тех пор ученые открыли еще один антибиотик - кловибактин, который аналогичным образом воздействует на липид II и "сворачивается в надмолекулярную структуру", хотя и несколько отличается от теиксобактина.
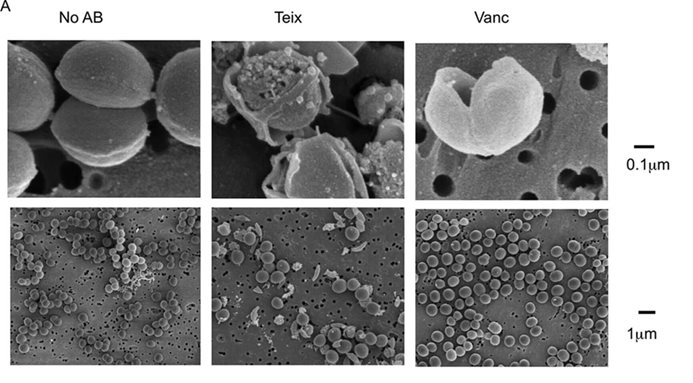
Теиксобактин повреждает клеточную мембрану. Здесь показаны клетки Staphylococcus aureus в отсутствие антибиотика (No AB) или обработанные теиксобактином (Teix) или ванкомицином (Vanc) - другим антибиотиком, который нацелен на липид II и нарушает синтез пептидогликана. Источник: Homma T., et al./Antimicrobial Agents and Chemotherapy, 2016.
"На основании этих данных можно сделать вывод... [что] природа очевидно разработала соединения, которые эволюционировали, чтобы избежать резистентности", - утверждает Льюис. "А наше представление о том, что является подходящей или пригодной для лечения мишенью, не имеет никакого значения, поскольку природа не обращает на это внимания".
В настоящее время теиксобактин находится на поздней стадии доклинической разработки. Также в коллекции NovoBiotic есть соединения, направленные против M. tuberculosis, а недавно компания получила финансирование на поиск противогрибковых препаратов для борьбы с грибковым патогеном Candida auris.
Борьба с грамотрицательными микроорганизмами
Открытие антибиотиков против грамположительных бактерий является значительным достижением. Однако Льюис признает, что существует огромная потребность в соединениях, направленных против грамотрицательных патогенов, которые особенно опасны с точки зрения резистентности к противомикробным препаратам (3 из 5 патогенов, включенных Центром по контролю и профилактике заболеваний США в список "неотложных" угроз резистентности к противомикробным препаратам", являются грамотрицательными). Однако при скрининге почвы "процент попадания" соединений, направленных на грамотрицательные бактерии, в 2 раза ниже, чем на грамположительные. По оценкам Льюиса, при стандартном способе отбора проб почвы потребуется 100 лет для поиска соединений против грамотрицательных бактерий.
Для решения этой проблемы Льюис и его сотрудники сужают область применения антибиотиков, сосредоточившись на бактериях, которые, по их мнению, предъявляют к антибиотикам те же требования, что и люди (например, активность против грамотрицательных бактерий, низкая токсичность, эффективность в естественных условиях). Оказалось, что бактерии, обитающие в кишечнике энтомопатогенных нематод, являются хорошими кандидатами. Антимикробные соединения, продуцируемые этими микроорганизмами, должны обладать низкой токсичностью для хозяина-нематоды, способностью проникать в ткани и работать против грамотрицательных патогенов, которые являются основными конкурентами в кишечнике нематоды.
На сегодняшний день этот подход оказался успешным. Например, в результате анализа изолятов кишечника нематод, принадлежащих к роду Photorhabdus, был обнаружен антибиотик даробактин, который активен против широко распространенных грамотрицательных патогенов (например, Pseudomonas aeruginosa, Klebsiella pneumonieae, Acinetobacter baumannii и др.) in vitro и на мышах, но проявляет ограниченную активность против грамположительных организмов и других симбионтов. Важно отметить, что даробактин воздействует на комплекс на поверхности грамотрицательных бактерий (комплекс BAM), что позволяет преодолеть необходимость обхода внешней мембраны, являющейся грозным барьером для многих соединений. Льюис отметил, что в настоящее время разрабатываются дополнительные соединения, полученные с помощью Photorhabus.
В целом, работа Льюиса и его коллег - от выращивания некультивируемых почвенных микробов до использования нематодных кишечных микробов - указывает на одну главную мысль: новые эффективные антибиотики уже существуют. Вопрос лишь в том, где (и как) их искать.

