Изучение инфекционных заболеваний в исследовательской лаборатории может быть похоже на сборку пазла семьей дома, хотя и с бесконечным количеством кусочков.
Десятки людей будут входить и выходить из исследовательской группы в течение многих лет, внося важный вклад в пазл, но так и не найдя последнего кусочка. В январе 2021 года Эллисон Краус нашла последний фрагмент в изучении молекулярной структуры инфекционного приона - головоломки, которую ее наставник, Байрон Коги начал решать 30 лет назад. Они вместе с многочисленной командой ученых впервые разгадали трехмерную структуру приона в высоком разрешении. Они также получили беспрецедентные, но с меньшим разрешением, изображения другого штамма приона. Определение структуры прионов и их разнообразия имеет фундаментальное значение для того, чтобы помочь исследователям понять, как развиваются прионные заболевания, как можно применять целевые методы лечения для замедления и предотвращения болезни, и как прионы соотносятся с белками, вызывающими родственные заболевания, такие как болезнь Альцгеймера и болезнь Паркинсона.
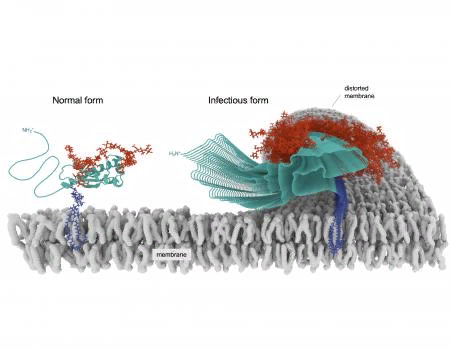
Для сравнения, нормальная форма прионного белка показана привязанной к клеточной мембране рядом с поврежденной формой, которая является инфекционной. Это графическое изображение было создано после того, как ученые проанализировали тысячи данных из изображений инфекционных прионов. Credit: CWRU and NIAID
Основа для разработки терапевтических средств
Прионные заболевания вызываются прионами, которые представляют собой поврежденные формы белка млекопитающих, называемого прионным белком, или PrP. Коги считает, что их исследование "Структура высокого разрешения и сравнение штаммов инфекционных прионов млекопитающих", опубликованное 23 августа в журнале Molecular Cell, даст коллегам исходный пример того, как нормальные молекулы PrP могут сворачиваться и аккумулироваться, вызывая заболевания.
"Основываясь на структуре в высоком разрешении, которую мы можем видеть, мы думаем, что патогенные стержнеподобные фибриллы PrP имеют липкие концы, которые захватывают нормальные молекулы PrP и распутывают их, как если бы они связывались с узкой змеевидной полоской липучки", - сказал он.
Ранее у ученых были лишь обоснованные догадки о структуре прионов, которыми они могли руководствоваться в своей работе. Две ведущие теории предполагали, что структура представляет собой либо ряд сложенных в штопор молекул - бета-соленоидная модель, либо то, что было предложено группой Коги в 2014 году и теперь подтвердилось: модель PIRIBS. PIRIBS, что расшифровывается как parallel-in-register intermolecular beta-sheet, показывает блиноподобные слои молекул PrP, образующие прионные фибриллы. Бета-листы являются ключевой лестничной субструктурой таких фибрилл.
Сравнивая новые изображения двух прионных штаммов грызунов, Краус и Коги смогли увидеть, что они заметно отличаются по структуре, что отчасти объясняет различные нейродегенеративные заболевания, которые они вызывают. Они признают, что эти первоначальные структуры не смогут объяснить все штаммы прионов, и что им необходимо, как говорит Коги, "гуманизировать понимание структур прионов".
Их структура в высоком разрешении относится к специфическому адаптированному к хомякам штамму Скрапи, прионной болезни, которая встречается в естественных условиях у овец и коз. Второй штамм, который они проанализировали, - это адаптированная к мышам форма Скрапи. Сейчас они анализируют, насколько структуры прионов различаются среди других прионных болезней. Определив первую подробную структуру высокоинфекционного приона, ученые также задумались о факторах, которые контролируют степень передачи различных патологических белковых агрегатов, таких как при болезни Альцгеймера и Паркинсона. Имея в руках практически атомную структуру приона, они могут начать оценивать изменения, происходящие в процессе преобразования нормального PrP в инфекционную прионную форму. Это позволит ученым определить этапы, на которых лечение может быть эффективным для замедления или предотвращения распространения болезни.
"Мы и другие группы ищем препараты для стабилизации нормальных молекул PrP и предотвращения их аномального сворачивания",
- говорит Коги. "Другие пытаются разработать вакцины, которые могли бы распознавать прионы и либо блокировать их репликацию, либо помогать организму уничтожать их. Дальнейшая работа в этом направлении должна быть значительно облегчена благодаря точным знаниям о структуре прионов".
Прионные заболевания
Прионные заболевания - это трансмиссивные, не поддающиеся лечению смертельные заболевания головного мозга. При их обсуждении может возникнуть путаница: у всех млекопитающих есть молекулы PrP, которые, предположительно, выполняют нормальные физиологические функции как отдельные единицы. По неизвестным причинам молекулы PrP могут сворачиваться и организовываться в высокоструктурированные агрегаты, которые вызывают инфекционные заболевания. Это так называемые прионы - инфекционная форма молекул PrP.
Прионы могут размножаться в организме хозяина миллиард и более раз во время инфекции. Примечательно, что они делают это, не имея собственных генов, специфичных для инфекции, поскольку все молекулы PrP, будь то нормальные или патогенные, кодируются одним и тем же геном хозяина. Разница между этими формами PrP заключается в основном в форме, а не в последовательности аминокислот. Это означает, что ученые не могут легко отслеживать прионы, как это происходит с вирусами и бактериями. Все прионовые болезни летальны: Коги говорит, что 1 микрограмм - одна миллионная часть грамма - может содержать 100 миллионов смертельных доз.
В 1990 году Коги впервые увидел доказательства наличия бета-листов, которые в конечном итоге привели к созданию модели структуры прионов PIRIBS. Он и его коллеги, используя очищенный образец Скрапи, взятый у хомяков, были первыми учеными, которые получили представление об этой аберрантной структуре. Но это было сделано с помощью инфракрасного спектрометра, который измеряет поглощение инфракрасного света и не позволяет получить структурные детали.
Ученые часто используют адаптированные к грызунам штаммы скрапи в качестве прототипов для родственных прионных заболеваний человека (болезнь Крейтцфельдта-Якоба), крупного рогатого скота (коровье бешенство), оленей и лосей (хроническая болезнь истощения). Исследователи опубликовали результаты изучения бета-листов в прионах в 1991 году, и с тех пор Коги и многие молодые ученые, которых он наставлял, работали над усовершенствованием этой работы. Использованный тогда штамм скрапи хомячка 263K - тот же самый, что и в их недавнем исследовании.
Революция в степени разрешения
В 2019 году Краус открыла свою собственную независимую лабораторию, но, что важно, сотрудничество с лабораторией Коги продолжалось - теперь Краус имела доступ к новому, усовершенствованной криогенной электронной микроскопии. Используя протоколы и систему, разработанную коллективом в течение многих лет, Коги готовил образцы для отправки Краус для получения изображений а Краус отправляла Коги терабайт за терабайтом данные, которые затем анализировались и включались в разрабатываемую модель.
К осени 2020 года - во время пандемии - группы получили изображения прионов скрапи с беспрецедентным разрешением и, используя недавно разработанные вычислительные методы, продемонстрировали огромные перспективы для создания первой модели на атомном уровне. Зная, что они близки к цели, Краус вспоминает, что работал день и ночь в течение ноября и декабря 2020 года и в 2021 году. По словам Крауса, "было много встреч, телефонных звонков, текстовых сообщений и удаленных вычислительных задач", в ходе которых было получено около 13 000 изображений в высоком разрешении. "Это исследование охватило много различных аспектов науки, от биологии прионов до биохимии прионов, технологии микроскопии, программного обеспечения, математики, компьютерной графики, чтобы собрать все это вместе".
Затем, в начале января 2021 года, последняя деталь: "Когда огромные массивы данных были проанализированы, мы впервые поняли, что можем визуализировать с высоким разрешением структуру приона. Это была такая веселая встреча по Zoom. Мы провели вторую половину дня, исследуя, что мы сделали правильно, что нет, а о чем даже не задумывались". "Наконец-то мы получили четкое представление о его отвратительном фотороботе", - добавил Коги.
Теперь они знают, что еще не закончили разгадывать головоломку. Краус и Коги говорят, что их первая полноценная структура инфекционного приона - одна из многих, которые потребуются для понимания всего спектра этих смертоносных, необычных, белковых патогенов. Или, как выразился Краус,
"последний кусочек" этой 30-летней головоломки - это лишь первый кусочек в новом проекте по изучению этих аберрантных белковых структур".