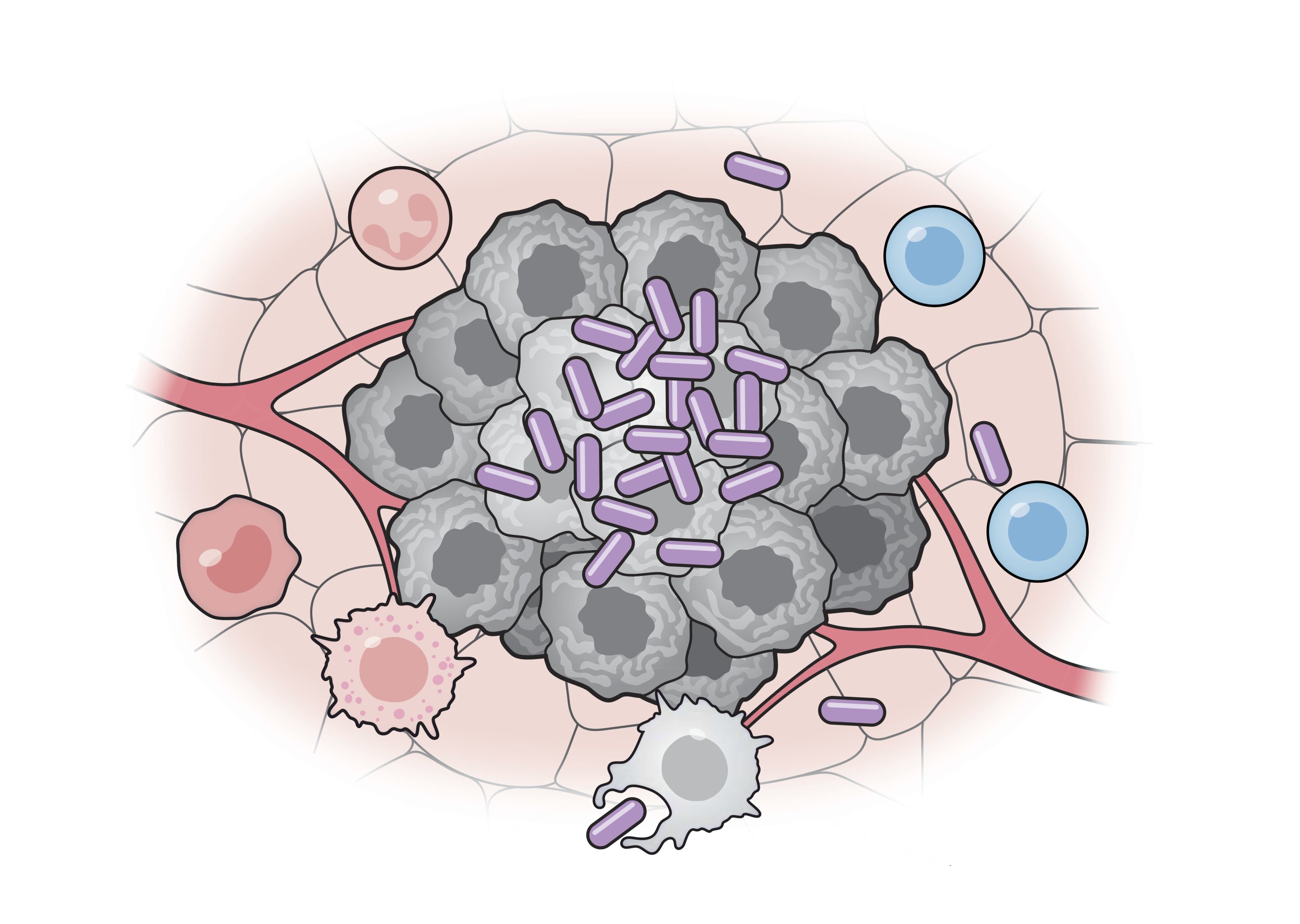
Бактерии способствуют активации как врожденного, так и адаптивного иммунитета благодаря присущим им чужеродным и иммуностимулирующим свойствам.
Эти свойства в сочетании с легкостью синтеза бактерий для безопасной доставки иммуномодулирующих соединений делают их идеальными векторами для усиления и направления противоопухолевого иммунного ответа. Опухолевые неоантигены являются привлекательной иммунотерапевтической полезной нагрузкой для доставки; эти антигены не присутствуют в других тканях, представляют минимальный риск индуцирования аутоиммунитета и теоретически исключены из центральных механизмов иммунологической толерантности.
К настоящему времени различные вакцины против опухолевых неоантигенов продемонстрировали многообещающий иммунологический ответ и положительный эффект в клинических испытаниях, хотя их применение по-прежнему ограничивается лишь некоторыми группами пациентов. В этой связи программирование бактерий с помощью генетических директив на выделение высоких уровней идентифицированных опухолевых неоантигенов позволяет создать систему точного нацеливания на неоантиген in situ.
В исследовании ученых Колумбийского университета описываются новые микробные векторы иммунотерапии, которые стимулируют эффективный и стойкий опухолевый антиген-специфический иммунитет и подавляют иммуносупрессивные механизмы, которые в противном случае могут ограничивать действие традиционных неоантигенных вакцин. Исследователи создали пробиотические бактерии, которые обучают иммунную систему уничтожать раковые клетки, что открывает путь к созданию нового класса противораковых вакцин, использующих естественные свойства бактерий, нацеленных на опухоли. Эти микробные вакцины против рака могут быть персонализированы для воздействия на первичную опухоль и метастазы каждого человека и даже могут предотвратить будущие рецидивы. В экспериментах на мышиных моделях колоректального рака и меланомы бактериальная вакцина усиливала иммунную систему, подавляя рост первичных и метастатических раковых опухолей, а во многих случаях и уничтожая их. Результаты исследования были опубликованы 16 октября в журнале Nature в статье под названием "Пробиотические векторы доставки неоантигенов для прецизионной иммунотерапии рака".
Бактериальная вакцина оказалась особенно более эффективной, чем терапевтические противораковые вакцины на основе пептидов, которые использовались в многочисленных предыдущих клинических исследованиях рака. «Важным преимуществом нашей системы является ее уникальная способность координированно перестраивать и активировать все звенья иммунной системы, чтобы вызвать продуктивный противоопухолевый иммунный ответ. Мы считаем, что именно поэтому система так хорошо работает в моделях солидных опухолей, которые особенно трудно поддаются другим видам иммунотерапии", - рассказывает соавтор работы Эндрю Реденти. "В результате бактериальная вакцина способна контролировать или устранять рост первичных или метастатических опухолей и увеличивать выживаемость в мышиных моделях".
«Каждый рак уникален - опухолевые клетки несут в себе определенные генетические мутации, которые отличают их от нормальных здоровых клеток. Запрограммировав бактерии, которые направят иммунную систему на эти специфические для рака мутации, мы сможем разработать более эффективную терапию, стимулирующую собственную иммунную систему пациента обнаруживать и уничтожать раковые клетки", - поясняет он. «По мере того как мы продолжаем интегрировать дополнительные оптимизации безопасности путем дальнейшего генетического программирования, мы все ближе подходим к моменту тестирования этой терапии на пациентах».
Бактерии используются для лечения рака с конца XIX века, когда Уильям Коули, работавший хирургом в Нью-Йоркской больнице, наблюдал регресс опухоли у части пациентов с неоперабельными опухолями, которым вводили бактерии. Бактерии и сегодня используются в качестве терапевтического средства для лечения пациентов с ранней стадией рака мочевого пузыря. Исследователи теперь знают, что некоторые бактерии могут естественным образом мигрировать в опухоли и колонизировать их, где они могут процветать в часто лишенной кислорода среде и локально стимулировать иммунный ответ. Однако при таком использовании бактерии обычно не могут точно контролировать или направлять иммунный ответ для атаки на рак. "Сами по себе эти качества обычно не дают бактериям достаточной силы для стимулирования иммунного ответа, способного уничтожить опухоль, но они являются хорошей отправной точкой для создания новой области терапии рака", - отмечает Реденти.
Новая система основана на пробиотическом штамме бактерий E. coli. Исследователи провели множество генетических модификаций, чтобы точно контролировать способ, которым бактерии взаимодействуют с иммунной системой и обучили их уничтожать опухоли. Сконструированные бактерии кодируют белковые мишени, так называемые неоантигены, которые специфичны для рака, подлежащего терапии. Доставляемые бактериями неоантигены обучают иммунную систему нацеливаться на раковые клетки, экспрессирующие те же белки, и атаковать их. Неоантигены используются в качестве мишеней для опухолей, поэтому нормальные клетки, в которых отсутствуют эти белки-маркеры, остаются незатронутыми. Благодаря природе этой бактериальной системы и дополнительным генетическим модификациям, разработанным учеными, эти бактериальные методы лечения рака одновременно преодолевают иммуносупрессивные механизмы, которые опухоли используют для блокирования иммунной системы.
При тестировании на мышах исследователи обнаружили, что эти сложно запрограммированные бактериальные вакцины против рака привлекают широкий спектр иммунных клеток, которые атакуют опухолевые клетки, при этом предотвращая реакции, которые обычно подавляют иммунные атаки, направленные на опухоль. Бактериальная вакцина также уменьшала рост рака, когда ее вводили мышам до развития опухолей, и предотвращала повторный рост тех же опухолей у вылеченных мышей, что позволяет предположить, что вакцина способна предотвратить возвращение рака у пациентов, переживших ремиссию.
В случае с людьми первым шагом в создании таких микробных вакцин будет генетическая характеристика рака пациента и выявление его уникальных неоантигенов с помощью биоинформатики. Затем бактерии будут сконструированы таким образом, чтобы производить большое количество идентифицированных неоантигенов, а также других иммуномодулирующих факторов. Поскольку каждая опухоль имеет свой набор неоантигенов, иммунотерапия будет подбираться индивидуально для каждого пациента. «Время лечения в первую очередь будет зависеть от того, сколько времени потребуется для генетической характеристики опухоли. Затем нам нужно будет только создать штаммы бактерий, что может быть сделано довольно быстро. Бактерии могут быть проще в производстве, чем некоторые другие вакцинные платформы», - говорит Реденти.
Бактерии также разработаны таким образом, чтобы противодействовать способности рака быстро мутировать и уклоняться от лечения. Исследователи считают, что их подход может оказаться успешным там, где не справились более ранние вакцины против рака. В последних, хотя иммунный ответ против неоантигенов опухоли может быть вызван, прямое модулирование иммуносупрессивной опухолевой среды не достигается в такой степени. Реденти добавляет: "Бактерии позволяют доставить более высокую концентрацию неоантигенов, чем это может быть допустимо при их системной доставке по всему организму. Здесь же мы можем ограничить доставку непосредственно опухолью и локально регулировать стимулирование иммунной системы».