Распространение механизмов бактериальной резистентности происходит гораздо быстрее, чем разработка новых методов лечения.
Новые инвестиции в исследования противомикробных препаратов не поощряются из-за их высокой себестоимости и длительного процесса разработки. Кроме того, неправильное использование и чрезмерное назначение антибиотиков, обусловленные неопределенностью в диагностике, способствуют эскалации кризиса резистентности к противомикробным препаратам (AMR). Отсутствие средств быстрой диагностики напрямую влияет на первоначальные решения о терапии, что может привести к эмпирическому лечению, основанному только на клинической картине.
Фенотипическая диагностика в настоящее время считается золотым стандартом в оценке AMR. Несмотря на усилия по обеспечению быстрого фенотипического тестирования (∼7 ч) (Pancholi et al., 2018) для лучшего руководства антибиотикотерапией, наиболее используемые методы по-прежнему требуют культивирования микроорганизмов, время выполнения которых составляет около 18 ч. Это задерживает получение профилей AMR, которые могут быть доступны в течение 72 ч после сбора образца. Помимо ограничения по времени получения результата, фенотипические тесты обычно требуют лабораторной инфраструктуры. Поэтому для принятия первых врачебных решений о назначении антимикробной терапии во всем мире необходимы более быстрые и доступные диагностические инструменты.
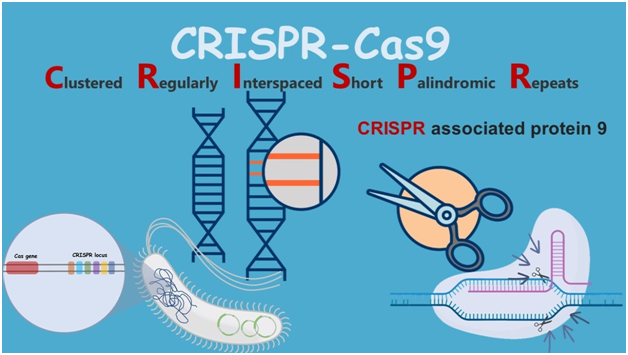
В постгеномную эру молекулярные методы лечения и диагностики рассматриваются как мощные методы борьбы с кризисом AMR. Среди молекулярных подходов аптамеры и CRISPR-Cas получили поддержку благодаря своей практичности, чувствительности и гибкости для взаимодействия с различными вне- и внутриклеточными мишенями. Эти характеристики позволили разработать быстрые и локальные диагностические инструменты, а также альтернативные методы лечения панрезистентных бактериальных инфекций. Мы предполагаем, что в ближайшем будущем CRISPR-Cas и аптамеры могут быть объединены для лечения и/или диагностики резистентных бактериальных инфекций благодаря их взаимодополняющим характеристикам.
Во всем мире отмечается значительный рост применения аптамеров в исследовательских и клинических институтах (McKeague et al., 2015). Также называемые химическими антителами, большинство аптамеров взаимодействуют со своими мишенями в постоянном равновесии с аффинностью связывания до 1 pM (Ha et al., 2017). Они обеспечивают дешевое крупномасштабное производство с химическими модификациями, низкую или нулевую иммуногенность, малый размер (близко к 3 нм), гибкость трехмерной структуры и большую стабильность в различных условиях pH, температуры и органических растворителей (Yoon and Rossi, 2018).
Несмотря на высокий спрос, потенциал CRISPR-Cas и аптамеров в лечении бактериальных инфекций изучен мало. Что касается подхода CRISPR-Cas, необходимо учитывать иммуногенность Cas9 (Crudele and Chamberlain, 2018), а также определить наиболее подходящий метод доставки для оптимизации эффекта CRISPR-Cas в отношении бактерий в сложных микробных сообществах.
Будут ли комбинированные характеристики CRISPR-Cas и аптамеров полезны для диагностики AMR и лечения инфекций, вызванных резистентными бактериями, еще предстоит выяснить. В одном из недавних исследований была разработана стратегия распознавания поверхностных белков штаммов MRSA с помощью аптамеров и CRISPR-Cas12a-ассистированной амплификации (Xu et al., 2020). Тем не менее, предстоит протестировать множество комбинаций CRISPR-Cas/аптамеров и бактерий-мишеней, а также провести дальнейшую оптимизацию для достижения аттомолярной чувствительности.
Даже при таком потенциале необходимо провести дополнительные исследования, чтобы проложить путь для их успешного использования против AMR. В данном обзоре мы выделяем эти два надежных метода и призываем исследователей усовершенствовать их для борьбы с AMR. Кроме того, мы описываем, как аптамеры и CRISPR-Cas могут работать вместе с текущим набором инструментов для диагностики и лечения.
Исследования, использующие аптамеры и CRISPR-Cas для диагностики, продемонстрировали их способность давать результаты в более короткие сроки по сравнению с золотым стандартом фенотипических тестов AMR, которые могут занимать до 72 часов. Это, наряду с возможностью разработки диагностических средств на бумажных носителях, подчеркивает потенциал методов для использования в качестве первого руководства для принятия клинических решений, связанных с использованием противомикробных препаратов. В целом, молекулярные подходы могут предложить подходящее решение для предотвращения злоупотребления антибиотиками при первом назначении антибиотика, которое в настоящее время основывается только на эмпирических решениях.