Наиболее распространенным и основным механизмом бактериальной резистентности является деградация β-лактамных антибиотиков путем гидролиза, который был впервые описан в 1940 году.
Производимые бактериями β-лактамазы катализируют гидролиз β-лактамов, препятствуя ацетилированию и, следовательно, делая невозможным ингибирование пенициллин-связывающего белка. Система классификации β-лактамаз по Эмблеру выделяет 4 группы в соответствии с их ферментативной структурой. Классы A, C и D содержат остаток серина в активном сайте (серин-β-лактамазы, SBL). Напротив, класс B относится к металло-β-лактамазам (MBL), которые приобретают свою активность благодаря одному или двум ионам цинка в активном сайте, что делает их резистентными к цефалозопринам и карбапенемам 4-го поколения.
Распространенность карбапенем-резистентных Enterobacterales (CRE) неуклонно растет с начала 1990-х годов, впервые описанных в Европе, а теперь достигших глобальных масштабов, поэтому растущая резистентность грамотрицательных бацилл стимулирует разработку новых антибиотиков и новых комбинаций ингибиторов β-лактамаз. Цефтазидим-авибактам (CZA), одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США с февраля 2015 года, является примером таких комбинаций. Авибактам ковалентно связывается с сериновым остатком β-лактамазы. В отличие от клавулановой кислоты и тазобактама, молекула не подвергается гидролизу, она медленно диссоциирует и возвращается к своей первоначальной структуре, чтобы ингибировать новую β-лактамазу. Таким образом, авибактам восстанавливает активность цефтазидима (цефалоспорина третьего поколения) в отношении β-лактамаз класса А (ESBLs, KPCs), класса С (AMPc) и класса D (OXA-48). Однако авибактам (как и все ингибиторы β-лактамаз) остается неактивным в отношении MBL.
С другой стороны, MBL и OXA-48, в отличие от KPC, практически не связываются с азтреонамом (AT), предотвращая тем самым его гидролиз. Поэтому авибактам в комбинации с AT ценен в отношении штаммов MBL, утративших чувствительность к AT вследствие хромосомной депрессии (сверхэкспрессии) AMPc или приобретения плазмидного ESBL (CTX-M-типа, SHV-типа, TEM-типа), AMPc-типа (CMY-2) или KPC-типа.
S. maltophilia - еще одна известная мишень для применения комбинации β-лактама и ингибитора β-лактамазы. Сочетание двух внутренних и индуцибельных β-лактамаз, L1 и L2, придает естественную резистентность ко всем β-лактамным антибиотикам. L1 - это MBL (класс В по Эмблеру), которая придает устойчивость ко всем β-лактамам (включая ингибиторы β-лактамаз), кроме AT. L2, напротив, является чувствительной к клавулановой кислоте β-лактамазой (класс А по Эмблеру), гидролизующей большинство β-лактамов, включая цефалоспорины 2-го и 3-го поколений и AT. Совместное назначение ингибитора β-лактамазы, подавляющего L2, может предотвратить гидролиз AT и восстановить его активность против L1.
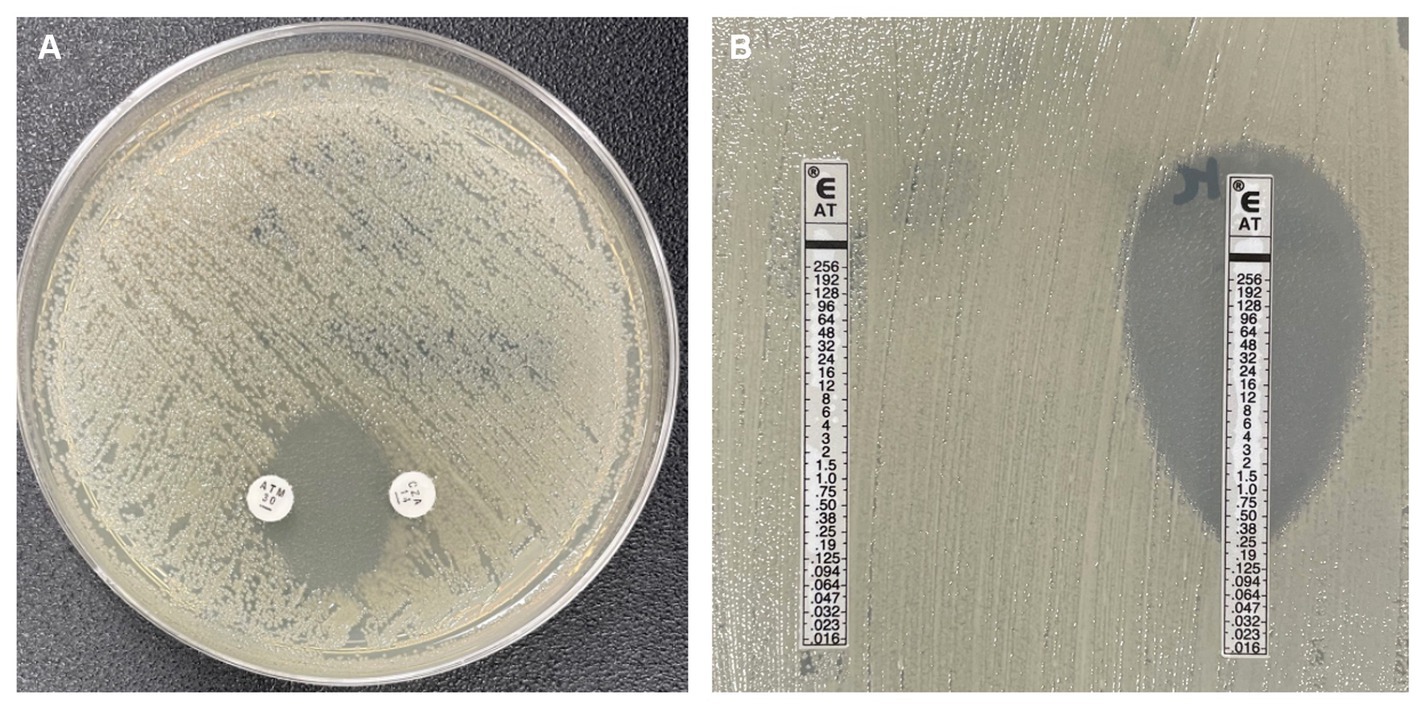
Поэтому важно оценить чувствительность этих штаммов бактерий к комбинации AT-авибактама (ATA). В отсутствие градиентных диффузионных полосок (ГДП) (Е-тестов) для определения чувствительности штаммов бактерий к ATA были предложены различные методы. Либо путем последовательного нанесения ГДП CZA и AT на чашку с агаром Мюллера-Хинтона (MHA), либо путем совмещения полосок, либо путем чередования ГДП. Несмотря на доступность этих методов, они требуют использования 2 полосок, либо одновременно, либо последовательно, в зависимости от выбранной процедуры. Помимо увеличения стоимости и объема работы, эта процедура требует дополнительной обработки, что может привести к погрешностям или бактериальной контаминации.
Чтобы ответить на этот вопрос, мы проверили метод наложения ГДП ATA, сравнив полученные результаты с результатами, полученными с помощью ГДП AT, нанесенной на чашки с агаром Мюллера-Хинтона, дополненные авибактамом (MH-AV), 4 мг/л. Мы также оценили использование двойного дискового синергетического теста (DDST) в качестве скринингового инструмента для выявления синергизма между AT и авибактамом, который может быть полезен при выборе ГДП с целью экономии ресурсов.
Результаты: При использовании MH-AV все SBL- и MBL-положительные Enterobacterales были чувствительны или восприимчивы при повышенном воздействии комбинации AT-авибактам. Напротив, только 2 из 12 (17%) штаммов P. aeruginosa и 9/11 (82%) штаммов S. maltophilia были чувствительны или восприимчивы при повышенной экспозиции к комбинации AT-авибактама. DDST выявил все синергизмы, продемонстрировав 100% чувствительность и 100% отрицательную предсказательную ценность для всех штаммов бактерий.
Выводы: DDST является чувствительным инструментом для скрининга синергизма антибиотиков. В отличие от S. maltophilia и SBL- и MBL-положительных Enterobacterales, большинство MBL-положительных штаммов P. aeruginosa остаются резистентными к AT-авибактаму. Для определения МИК комбинации AT-авибактама предпочтительнее использовать ГДП ATA, а метод суперпозиции ГДП может быть использован в качестве альтернативы коммерческому тесту.