Большинство микроорганизмов имеют различные механизмы выживания в стрессовых условиях, такие как протеолитические системы и регуляция роста.
Чаще всего бактерии живут в биопленках, которые обеспечивают защитную нишу для выживания микроорганизмов. Бактериальные биопленки определяются как структурированные микробные сообщества, заключенные в самосинтезирующееся внеклеточное полимерное вещество (EPS) и прикрепленные к ткани или поверхности, включающие экзополисахариды, матричные белки и внеклеточную (экстрацеллюлярную) ДНК (эДНК). В клинических условиях длительная колонизация бактерий в организме человека вызывает хронические инфекции, главным образом потому, что бактерии в биопленках устойчивы к иммунным реакциям хозяина и антибиотикотерапии. Исследования показали, что 65-80% патогенных инфекций в больницах связаны с биопленками и хотя для клинического применения доступны многочисленные противомикробные препараты, они лишь подавляют симптомы инфекции и не способны уничтожить бактерии, внедренные в биопленки.
Pseudomonas aeruginosa - грамотрицательная условно-патогенная бактерия, широко распространенная в природе. Установлено, что P. aeruginosa участвует в разнообразных инфекциях, как вне-, так и внутрибольничных, включая пневмонию, муковисцидоз, инфекции мочевыводящих путей и ожоговые инфекции. Антимикробные препараты, одобренные для клинического применения, могут оказаться неэффективными при лечении инфекций, вызванных P. aeruginosa, поскольку эта бактерия обладает способностью образовывать биопленки. Образование биопленок позволяет P. aeruginosa противостоять внешним неблагоприятным условиям и усиливает ее колонизацию в организме хозяина. Биопленки также могут действовать как диффузионные барьеры, ограничивая проникновение антибиотиков в бактериальные клетки (Drenkard, 2003; Pang et al., 2019).
Поскольку P. aeruginosa является одним из основных патогенов, вызывающих оппортунистические инфекции у людей, клиническое лечение и контроль инфекций, вызванных P. aeruginosa, стали серьезной проблемой и предметом обширных исследований. Образование биопленки эффективно способствует колонизации P. aeruginosa, повышая резистентность бактерий к антимикробным препаратам и противодействуя иммунной системе хозяина. Поэтому традиционная терапия одним антибиотиком ограничена в лечении биопленочных инфекций, и все большее число исследований посвящено разработке новых антимикробных препаратов и антибиопленочных терапевтических программ для лечения инфекции P. aeruginosa. В данном обзоре будет представлен процесс формирования биопленки, а также регуляция биопленки и антибиопленочная терапия P. aeruginosa.
Состав, формирование и регуляция биопленки Pseudomonas aeruginosa
Компоненты матрикса биопленки P. aeruginosa, в основном включают экзополисахариды, эДНК и матричные белки, которые играют важную роль в поддержании структуры и лекарственной резистентности биопленок. P. aeruginosa может синтезировать как минимум три типа экзополисахаридов: альгинат, полисахарид Pel и полисахарид Psl.
Альгинат - это анионный полисахарид, состоящий из α-L-гулуроновой кислоты и β-D-маннуроновой кислоты, соединенных β-1-4 гликозидными связями. Избыточное производство альгината ответственно за развитие чрезмерных слизистых или мукоидных биопленок, а мукоидные биопленки более устойчивы к атаке иммунной системы хозяина и терапии антибиотиками, чем не мукоидные биопленки, что приводит к персистированию инфекции в организме.
Полисахарид Psl состоит из 15 совместно транскрибируемых генов (от pslA до pslO), которые кодируют белки для синтеза Psl, усиливают адгезию на поверхности клеток и между клетками P. aeruginosa, а также играют важную роль в инициации и поддержании структуры биопленки.
Pel - положительно заряженный экзополисахарид, состоящий из частично ацетилированных 1 → 4 гликозидных связей N-ацетилгалактозамина и N-ацетилглюкозамина, который важен для формирования биопленки на границе воздух-жидкость.
Pel и Psl являются основными структурными полисахаридами в немукоидных и мукоидных биопленках P. aeruginosa. Лизис клеток высвобождает ДНК в окружающую среду, и эта эДНК может использоваться в качестве вспомогательного компонента биопленок для обеспечения питательными веществами бактерий в биопленках в периоды дефицита питательных веществ. Помимо экзополисахаридов и эДНК, важными компонентами матриц биопленок считаются внеклеточные белки, включая вспомогательные элементы (в основном жгутики и фимбрии IV типа), цитоадгезины и лектины. Исследования показали, что эти компоненты в основном играют вспомогательную роль в качестве факторов адгезии и структурной поддержки в процессе формирования биопленки P. aeruginosa (Qi and Christopher, 2019).
Формирование структуры биопленки P. aeruginosa представляет собой непрерывный процесс, включающий четыре основных этапа (см. рисунок).
Первая стадия - первоначальное прикрепление. На этом этапе адгезия обратима, и бактерии могут прикрепиться к поверхности или вернуться обратно в планктонные клетки. Многие ранние исследования начального прикрепления бактерий предполагали, что бактериальные клетки инициируют адгезию посредством кислотно-основных, гидрофобных и электростатических взаимодействий. Кроме того, производство полисахаридов также способствует межклеточной адгезии P. aeruginosa.
На втором этапе развития биопленки прикрепленные бактерии постепенно размножаются, превращаясь в более независимую структуру, и бактериальные клетки переходят от обратимого к необратимому прикреплению. На этой стадии бактерии растут, образуют микроколонии и начинают синтезировать EPS, который действует как барьер между клетками биопленки и окружающей средой, обеспечивая защиту от различных стрессовых условий, таких как воздействие антимикробных препаратов или атака иммунных клеток.
По мере продолжения секреции EPS клетки, образующие микроколонии, постепенно созревают и претерпевают различные физиологические изменения, образуя трехмерные грибоподобные структуры, состоящие из небольших каналов, которые транспортируют питательные вещества, воду и отходы, способствуют распределению питательных веществ и сигнальных молекул, а также межклеточной коммуникации. По мере созревания биопленки бактерии вырабатывают более сильную устойчивость к стрессу окружающей среды или антибиотикам.
Последним этапом развития биопленки является отслоение. Сообщалось о различных механизмах отслоения, таких как эрозия, слущивание и рассеивание. Отслоение биопленки знаменует собой переход клеток биопленки к планктонному способу роста, в результате чего клетки прикрепляются к поверхности других биомолекул или начинают новый цикл развития биопленки.
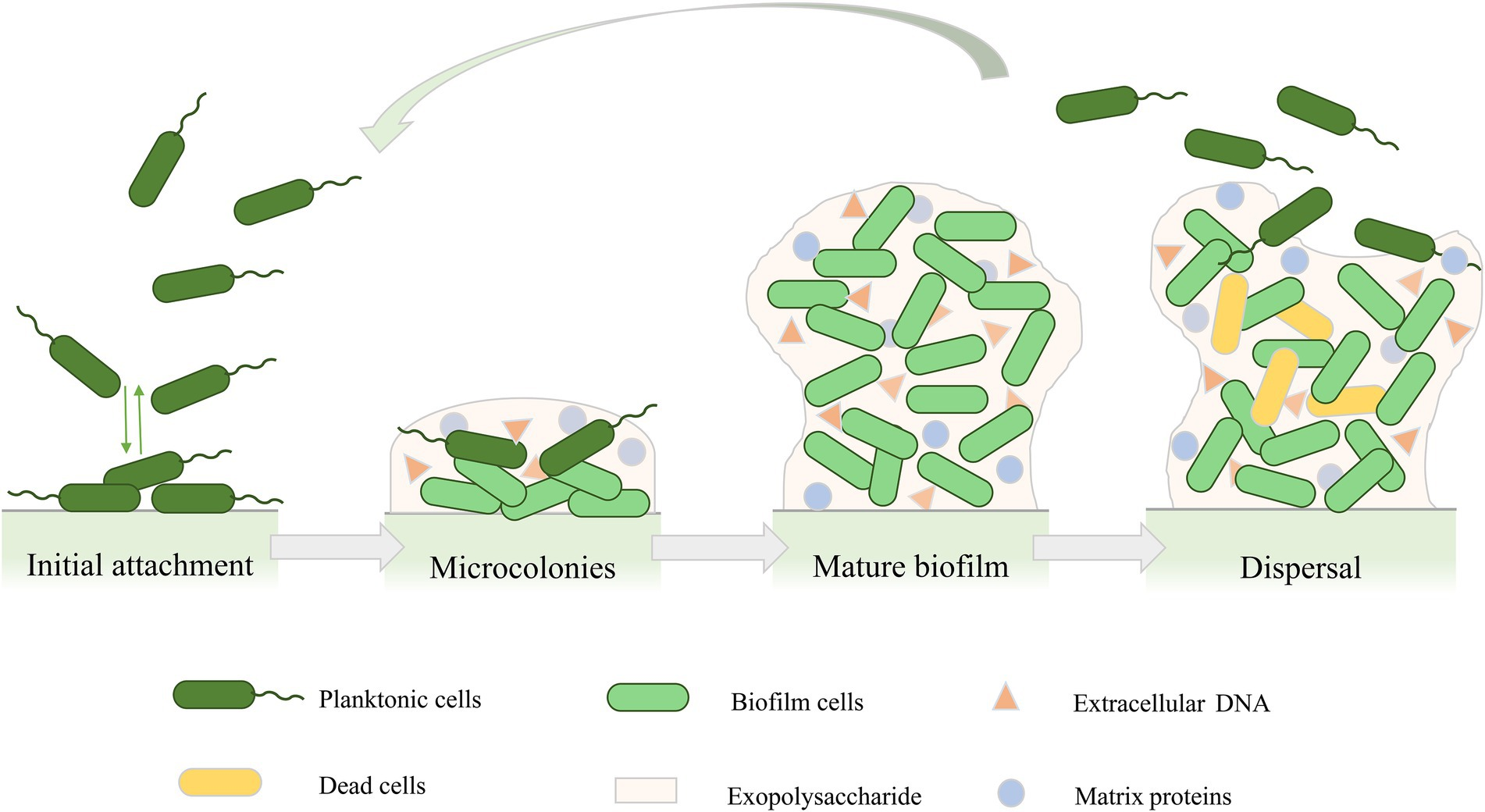
Рис.1. Цикл развития биопленки Pseudomonas aeruginosa. Формирование биопленки включает четыре стадии: начальное прикрепление, микроколонии, зрелая биопленка и рассеивание биопленки.
Матричные компоненты биопленок P. aeruginosa играют различные регуляторные роли на разных стадиях формирования. На ранней стадии формирования биопленки полисахариды Psl могут образовывать волокнистый матрикс, который спирально прикрепляется к поверхности бактериальных клеток и оборачивается вокруг бактерий, тем самым увеличивая контакт между бактериями и способствуя взаимодействию между бактериальными клетками, что приводит к сборке и ранней адгезии биопленки (эДНК также считается важным фактором, способствующим образованию биопленки P. aeruginosa, и участвует в первоначальном прикреплении бактериальных клеток, а также в соединении клеток между собой.
На более поздних стадиях созревания биопленок Pel может выполнять структурную и защитную роль в матриксе биопленки P. aeruginosa и повышать резистентность к аминогликозидным антибиотикам. Продукция многочисленных EPS может способствовать росту биопленки за счет обеспечения структурных каркасов и поддержания функции биопленки. Кроме того, кворум сенсинг (QS), как зависящий от плотности клеток бактерий сигнальный механизм, играет ключевую роль в регуляции формирования биопленки P. aeruginosa.
У P. aeruginosa существует как минимум четыре системы QS: las, rhl, pqs и iqs. Как две основные системы QS P. aeruginosa, системы las и rhl используют ацил-гомосерин лактон (AHL) в качестве сигнальной молекулы, которая связывается с рецепторным белком сигнальной молекулы и играет регуляторную роль. Система las репрессирует локус pel - оперон, кодирующий синтез полисахаридов внеклеточного матрикса, которые вызывают образование и дисперсию биопленки, а система rhl положительно регулирует производство биосурфактанта рамнолипида, который важен для позднего формирования биопленки. Система pqs P. aeruginosa использует 2-алкил-4-хинолоны (AQs) в качестве сигнальных молекул. Эти AQ в основном включают 2-гептил-3-гидрокси-4-хинолон (PQS) и его предшественник 2-гептил-4-гидроксихинолин (HHQ), оба из которых распознаются когнатным рецептором MvfR (Multiple virulence factor regulator), QS фактором транскрипции P. aeruginosa, также известным как PqsR. Благодаря взаимодействию с этим рецептором HHQ и PQS индуцируют экспрессию целого ряда генов, включая собственный каскад биосинтетических ферментов и гены, участвующие в формировании биопленки.
Стратегии борьбы с биопленками: современные подходы и перспективы
Антибиотики широко используются для лечения биопленочных инфекций, однако клиническое лечение по-прежнему сталкивается со многими проблемами из-за проблем с лекарственной резистентностью, биопленочных матриц, препятствующих проникновению лекарственных препаратов, и их взаимодействия с микробами. Поэтому было разработано множество новых антибиопленочных технологий, таких как комбинирование антибиотиков и использование новых стратегий, например, терапии галлием, фаговой терапии и антимикробной фотодинамической терапии (aPDT), для подавления образования биопленки.
Антибиотики
Хорошо известно, что антибиотикотерапия является наиболее важной и эффективной мерой борьбы с бактериальной инфекцией. Однако бактериальные биопленки обладают высокой резистентностью к антибиотикотерапии и иммунному ответу. Из-за низкой проницаемости внешней мембраны P. aeruginosa и ее собственных адаптивных механизмов она менее восприимчива к большинству антибиотиков и легко достигает клинической резистентности. Поэтому использование отдельных антибиотиков для лечения инфекций, вызванных биопленками P. aeruginosa, представляет значительные трудности, и были разработаны различные стратегии борьбы с биопленками и предотвращения развития резистентности к антибиотикам, включая повышение концентрации антибиотиков или использование антибиотиков в комбинации. В данном обзоре мы разделяем механизм действия комбинированных антибиотиков на две основные категории: синергетический эффект между различными антибиотиками и комбинированное применение других веществ и антибиотиков.
Комбинации антибиотиков, которые были признаны эффективными против биопленки P. aeruginosa, включают гентамицин/ципрофлоксацин и тобрамицин/кларитромицин. Эти комбинации повышают терапевтическую эффективность антибиотиков против биопленок P. aeruginosa. Помимо синергетического эффекта между антибиотиками, такие вещества, как хелаторы металлов, жирные кислоты и аминокислоты в сочетании с антибиотиками также помогут предотвратить образование биопленок P. aeruginosa.
Линоленовая кислота (LNA) - это незаменимая жирная кислота, которая оказывает антибактериальное действие на различные микроорганизмы. Исследования показали, что LNA может не только нарушать межклеточную коммуникацию и снижать выработку факторов вирулентности, но и усиливать действие тобрамицина и синергично подавлять образование биопленки, воздействуя на системы кворум-сенсинга P. aeruginosa. Катионный хелатор ЭДТА действует как терапевтический адъювант для дестабилизации матриц биопленок. Некоторые исследования показали, что сочетание ЭДТА и антибиотиков может быстро и устойчиво удалять биопленки, сформированные in vivo, по сравнению с использованием только антибиотиков (Chauhan et al., 2012; Lebeaux et al., 2015).
Глутамин - это аминокислота, которая используется в качестве источника питания, и экзогенное добавление глутамина может стимулировать приток ампициллина, что приводит к накоплению внутриклеточных концентраций антибиотика, превышающих количество, переносимое бактериями с множественной лекарственной резистентностью. Было установлено, что усиленное глютамином ампициллин-опосредованное уничтожение эффективно против биопленок P. aeruginosa в мышиной модели инфекции мочевыводящих путей. Более того, глутамин также замедляет развитие резистентности к ампициллину, что может помочь в будущей разработке эффективных антибиотических препаратов для предотвращения или лечения трудноизлечимых бактериальных биопленок. Кроме того, добавление дополнительного O2 с помощью гипербарической кислородной терапии (HBOT) может повысить восприимчивость патогенов к нескольким антибиотикам против метаболически активных бактерий путем активации аэробного дыхания. При сочетании с тобрамицином или ципрофлоксацином повторная оксигенация с помощью HBOT усиливала уничтожение клинической P. aeruginosa и уничтожение биопленок.
Эксперименты in vitro и in vivo показали, что минимальная ингибирующая концентрация (МИК) и минимальная бактерицидная концентрация бактериальных клеток биопленки обычно намного выше, чем у планктонных клеток (примерно в 10-1000 раз). Поэтому трудно добиться уничтожения биопленок in vivo при использовании обычных одиночных антибиотиков, в то время как сочетание антибиотиков с другими антибиотиками или другими веществами для усиления их действия как новая стратегия лечения биопленочных инфекций имеет широкие перспективы. Помимо антибиотиков, для лечения инфекции биопленок P. aeruginosa клинически использовались различные соединения. Эти методы терапии можно условно разделить на две категории: предотвращение образования биопленок и разрушение сформированных биопленок. Например, антимикробные пептиды (AMPs) и ингибиторы кворум-сенсинга (QSIs) могут предотвратить образование биопленки, регулируя процесс ее формирования, а некоторые гидролазы экзополисахаридов и ДНКазы могут воздействовать на компоненты матрикса биопленки для ее разрушения.
AMPs
Клиническое применение AMPs расширяется по мере роста резистентности к антибиотикам во всем мире. AMP представляют собой макромолекулы, состоящие из аминокислот, которые обладают способностью стимулировать врожденные иммунные реакции и проявляют мощную активность против широкого спектра видов бактерий, грибов, простейших и инкапсулированных вирусов. Общепризнано, что большинство AMP могут напрямую связываться с бактериальной поверхностью, например, с липополисахаридом (LPS) грамотрицательных бактерий, а затем деполяризоваться и проникать через мембрану.
LL-37, классический AMP человека, был идентифицирован как продукт, способный разрушать бактериальные мембраны, приводить к гибели клеток и подавлять образование биопленки P. aeruginosa, но последующие исследования показали, что в суб-ингибирующих концентрациях он может способствовать мутациям ДНК P. aeruginosa и вызывать ее резистентность к антибиотикам. Несмотря на это, как потенциальные ингибиторы биопленки, AMP все еще имеют большие перспективы для целенаправленного устранения распространения биопленки у бактерий с множественной и широкой лекарственной резистентностью. Мишенью этих AMP в клетке обычно является клеточная мембрана. Взаимодействуя с клеточной мембраной бактерий и проникая через нее, AMP вызывают гибель бактерий, тем самым снижая вероятность развития бактериальной резистентности. Как перспективный класс соединений для преодоления устойчивости к противомикробным препаратам, AMPs, как было показано, имеют некоторые преимущества перед традиционными антибиотиками. В нескольких исследованиях подробно описывается механизм действия AMPs (Annunziato and Costantino, 2020; Talapko and Skrlec, 2020). В данном обзоре механизмы антибиопленочного действия AMP разделены на две категории.
AMP первой категории проявляют антибиопленочную активность через механизм растворения мембран, который непосредственно влияет на целостность мембран бактериальных клеток и клеточных стенок. Было установлено, что антибиопленочный пептид P5 обладает способностью воздействовать на проницаемость мембран P. aeruginosa и оказывает синергическое и бактерицидное действие с карбапенемным антибиотиком меропенемом. Анализ проницаемости внешней мембраны показал, что P5 легко проникает через клеточную мембрану при концентрациях ниже 0,5 × МИК, что обусловлено тем, что меропенем проникает в цитоплазматическое пространство, мешая образованию пептидогликанов в клеточной стенке. Помимо меропенема, другие антибиотики могут действовать на биопленки P. aeruginosa синергично с AMP, например имипенем и тобрамицин.
AMPs второй категории влияют на характер роста биопленок, ингибируя адгезию бактерий и вмешиваясь в экспрессию генов. Хотя AMP обычно рассматриваются как мембранно-активные молекулы, которые разрушают биопленки путем нарушения клеточной стенки/мембраны, AMP также обладают многофункциональной активностью, такой как синтез белка и экспрессия генов в нескольких местах в мембране или внутри клетки, что позволяет им эффективно уничтожать бактерии. Новый синтетический катионный пептид 1 037 может значительно уменьшить образование биопленки P. aeruginosa и привести к гибели клеток в биопленках при определенных концентрациях. Анализ его влияния на экспрессию генов показал, что 1 037 непосредственно ингибирует биопленки, снижая плавательную и роевую подвижность, стимулируя двигательную активность при скручивании и подавляя экспрессию различных генов, участвующих в образовании биопленки, таких как PA2204.
Недавние исследования показали, что антибиопленочный пептид MC1 может ингибировать образование биопленки, снижая относительный уровень экспрессии генов pelA, algD и pslA у P. aeruginosa и уменьшая синтез экзополисахаридов (Yu et al., 2019). Другой хорошо изученный AMP, называемый WLBU2, и его энантиомер D-аминокислоты D8 также показали генномодулирующую активность против P. aeruginosa в биопленочном режиме роста, а также повышенную безопасность, стабильность и антимикробную эффективность при замене L-аминокислот в WLBU2 на D-аминокислоты.
Поскольку антибиопленочные пептиды могут подавлять образование биопленок или удалять зрелые биопленки, они постепенно признаются все большим числом исследователей в качестве потенциального нового препарата для профилактики и лечения бактериальных биопленочных инфекций. Однако до сих пор существует множество препятствий для их клинического применения. Например, антибиопленочные пептиды обычно проявляют определенную степень гемолиза или цитотоксичности для эукариотических клеток, они легко гидролизуются протеазами и не могут стабильно существовать в естественных условиях. Кроме того, высокая стоимость производства антибиопленочных пептидов и длительный цикл разработки препаратов также ограничивают их потенциальное клиническое применение.
QSIs
В последние годы все большее число исследований посвящено разработке новых антибактериальных препаратов путем воздействия на конкретные факторы вирулентности или их регуляторные механизмы для снижения появления резистентных к препаратам штаммов. Одна из таких стратегий направлена на вмешательство в QS-опосредованную сигнализацию. Система QS P. aeruginosa состоит из четырех систем, которые взаимодействуют, образуя сложную сеть межклеточной коммуникации, которая регулирует экспрессию генов, связанных с вирулентностью, и формирование биопленки в зависимости от плотности клеток путем генерирования сигнальных молекул QS.
QSIs могут быть как природными, так и синтетическими, и оба типа QSIs могут ингибировать формирование биопленок, нацеливаясь на различные участки. В данном обзоре QSI подразделяются на две категории: QSI, которые ингибируют экспрессию системы QS, и QSI, которые вмешиваются в комбинацию между сигнальными молекулами и рецепторными белками.
Первый тип QSI вмешивается и ингибирует экспрессию системы QS, изменяя архитектуру биопленки P. aeruginosa и позволяя антибиотикам лучше проникать и эффективнее убивать бактериальные клетки. В одном из предыдущих исследований выделенные из природы растительные соединения транс-циннамальдегид и салициловая кислота эффективно подавляли как las, так и rhl QS системы, значительно ингибировали экспрессию генов регуляции QS и вирулентности у P. aeruginosa PAO1, а также снижали образование биопленки одновременно с подавлением экспрессии генов рамнолипидов. Кроме того, был разработан целый ряд синтетических ингибиторов биопленки. Ожидается, что хлорацетамид и аналоги малеимида, как мощные, лекарственные ингибиторы QS у P. aeruginosa, будут представлять значительный медицинский интерес. Эти ингибиторы проявляют мощную активность антагонистов LasR и подавляют экспрессию фактора вирулентности P. aeruginosa пиоцианина, а также образование биопленки у PAO1 и PA14. Кроме того, Chang et al. выделили новую серию галогенированных производных фуранона и обнаружили, что они эффективно ингибируют экспрессию lasB дозозависимым образом и демонстрируют значительное образование биопленок P. aeruginosa.
Вторая категория молекул QSI функционирует путем вмешательства и ингибирования комбинаций между сигнальными молекулами и рецепторными белками, которые необходимы для бактериальной межклеточной коммуникации, производства факторов вирулентности и формирования биопленки. Имбирь широко используется как лекарственное растение с сильными антимикробными свойствами. Зингерон является одним из основных компонентов сухого корня имбиря, содержится во многих травяных специях и может эффективно регулировать структуру биопленки P. aeruginosa. У P. aeruginosa зингерон ингибирует системы las, rhl и pqs, связываясь с соответствующими рецепторами (LasR, RhlR и MvfR), что нарушает клеточную коммуникационную сеть и в конечном итоге подавляет вирулентность и образование биопленки P. aeruginosa. Кроме того, MvfR, являясь важнейшим транскрипционным регулятором системы PQS P. aeruginosa, рассматривается как потенциальная мишень для ингибирования системы PQS-MvfR QS. Бензамид-бензимидазольное соединение M64 может ингибировать регулятор QS P. aeruginosa MvfR, что приводит к уменьшению образования биопленки и повышению чувствительности P. aeruginosa к антибиотикам. Недавно в одном из исследований было сообщено о новом классе QSIs под названием QSI4, который обладает превосходной активностью в ингибировании выработки пиоцианина и репортер-гена MvfR; в сочетании с антибиотиками QSI4 оказывает значительный синергетический эффект на устранение биопленок P. aeruginosa (Schutz et al., 2021).
Являясь важной системой межклеточной коммуникации у P. aeruginosa, система QS играет ключевую роль в регуляции формирования биопленки. QSIs ингибируют образование биопленки посредством антивирулентности, что может синергизировать эффективность антибиотиков, но не влияет на жизнеспособность бактерий. Клиническое применение QSIs позволит снизить развитие резистентности к антибиотикам, а также уменьшить некоторые токсические побочные эффекты. Поэтому в настоящее время QSIs являются перспективными лекарственными мишенями для профилактики и лечения инфекции P. aeruginosa.
Нацеливание на полисахариды
Будучи функционально богатыми и динамично изменяющимися сообществами, биопленки могут модифицировать компоненты матрикса, чтобы адаптироваться к изменениям различных условий окружающей среды и давления. У P. aeruginosa ферменты, воздействующие на EPSs биопленки, могут предложить общую стратегию предотвращения клинических биопленочных инфекций. Сами бактерии также синтезируют полисахариды или некоторые эндогенные ферменты, разрушающие матрикс, чтобы вызвать дисперсию биопленки, например гликозид-гидролазы.
Ключевым компонентом формирования биопленки является биосинтез экзополисахаридов Pel, Psl и альгината. Ферменты, действующие на внеклеточный матрикс, могут служить мишенями для разрушения биопленок. Альгинатная лиаза может разрушать альгинат путем β-элиминирования гликозидных связей, нарушая структуру и целостность биопленок и значительно увеличивая диффузию биопленки. Недавно в одном из исследований сообщалось об альгинат-лиазе (AlyP1400), очищенной из морской бактерии вида Pseudoalteromonas, которая может лечить инфекции P. aeruginosa в легких при муковисцидозе или другие инфекции, связанные с биопленкой P. aeruginosa, путем сочетания использования альгинат-лиазы с антибиотиками (Daboor et al., 2021).
Гликозидгидролазы альфа-амилаза и целлюлаза также могут расщеплять сложные полисахариды, переводить бактерии в планктонное состояние, эффективно разрушать биопленки P. aeruginosa и повышать эффективность антибиотиков. Кроме того, PelA и PslG, являясь гликозид-гидролазами природного происхождения, могут избирательно разрушать экзополисахариды в матриксе биопленки, разрушая ее. В одном из предыдущих исследований сверхэкспрессированный или экзогенно поставляемый PslG предотвращал образование биопленки, деградируя Psl (Yu et al., 2015). Как гидролаза, PelA может утилизировать полисахариды в периплазме, а ее деацетилазная активность связана с формированием биопленок и морфологией колоний.
Недавно наша исследовательская группа использовала P. aeruginosa в качестве исходного штамма для создания инженерной бактерии для направленного транспорта и доставки функциональных белков, которые могут использовать две полисахаридные гидролазы, PelA и PslG, для воздействия на биопленки. Сначала с помощью синтетической биологии была сконструирована бактерия, способная инициировать лизис собственных клеток, затем были введены рекомбинантные векторы для сверхэкспрессии двух генов гидролаз экзополисахаридов pelA и pslG. Наконец, влияние сконструированных бактерий на биопленку P. aeruginosa было обнаружено в экспериментах по формированию биопленки. Было обнаружено, что сверхэкспрессия pelA и pslG может накапливать гидролазы полисахаридов во внутриклеточном матриксе и высвобождать их во внеклеточный матрикс через сайт лизиса клеток для разрушения цитоскелетных компонентов биопленки Psl и Pel, в конечном итоге разрушая биопленку и предотвращая дальнейшее ее образование (Wang et al., 2021).
Внеклеточный матрикс биопленки P. aeruginosa в основном состоит из экзополисахаридов, которые участвуют в формировании и поддержании структуры биопленки. Однако некоторые бактериальные экзополисахариды могут выполнять функции, которые подавляют или дестабилизируют биопленку. В одном из предыдущих исследований было показано, что внеклеточные продукты P. aeruginosa, в основном полисахариды, разрушают сформировавшиеся биопленки (Qin et al., 2009).
Недавно было обнаружено больше экзополисахаридов, которые проявляют негативную активность в отношении формирования биопленок у P. aeruginosa. Бактериальный экзополисахарид (A101) не только ингибирует образование биопленок многих бактерий, но и разрушает сформировавшиеся биопленки. Кроме того, A101 увеличивал способность аминогликозидных антибиотиков уничтожать биопленку P. aeruginosa, что может указывать на потенциал A101 в разработке новых терапевтических стратегий для бактериальных инфекций, ассоциированных с формированием биопленок, и в ограничении образования биопленок на медицинских устройствах (Jiang et al., 2011). В одном из недавних экспериментов был обнаружен экзополисахарид EPS273, который уменьшает образование биопленки у P. aeruginosa путем снижения уровня экспрессии двухкомпонентной системы phoP-phoQ, которая затем регулирует уровень экспрессии QS-систем lasI/lasR и rhlI/rhlR. Система QS далее регулирует гены, участвующие в формировании биопленки, такие как гены, участвующие в производстве внеклеточного матрикса и факторов вирулентности, гены, участвующие в образовании жгутиков и подвижности клеток, а также гены, участвующие в приобретении железа (Wu et al., 2021).
ДНКза
эДНК играет структурную роль в формировании биопленок и может служить источником питательных веществ для бактерий в условиях голодания и участвует в облегчении опосредованного судорожной подвижностью расширения биопленок. Кроме того, эДНК взаимодействует с Psl, образуя eDNA-Psl, который обеспечивает структурную поддержку биопленки. Исходя из этих факторов, появляются лекарственные пути воздействия на матрицы биопленок с помощью эДНК.
Дезоксирибонуклеаза I (ДНКаза I) - единственный фермент, используемый клинически для разрушения биопленки P. aeruginosa. Этот терапевтический фермент разрушает биопленки путем гидролиза ДНК во внеклеточном матриксе. ДНК участвует в разрушении фосфодиэфирной связи в молекулярной основе эДНК в биопленках. Поскольку эДНК необходима для первоначального прикрепления и агрегации EPS на поверхности, это затрудняет формирование бактериями интактной биопленки. Поэтому незрелые биопленки P. aeruginosa более чувствительны к обработке ДНКазой, чем зрелые биопленки.
Некоторые исследования показали, что L-метионин (L-Met) может разрушать биопленки P. aeruginosa путем повышения регуляции генов ДНК и индуцирования экспрессии ДНК, тем самым нацеливаясь на эДНК в биопленках (Gnanadhas et al., 2015). Кроме того, было обнаружено, что некоторые ДНК-подобные белки способны препятствовать образованию бактериальных биопленок и разрушать их. ДНКаза1-like 2 (DNase1L2), экспрессированная в роговом слое эпидермиса человека, обладает ферментативной активностью, может разрушать эДНК и эффективно подавлять образование биопленок P. aeruginosa. Кроме того, покрытия с ДНКазой I используются в качестве антимикробных покрытий для современного медицинского оборудования. Иммобилизация ДНКазы Ι на поверхностях показала перспективность в снижении бактериальной адгезии к поверхностям, поскольку этот фермент нацелен на отдельные биопленки и может эффективно расщеплять эДНК на поверхности бактериальных клеток, которые необходимы для бактериальной адгезии. В условиях продолжающегося роста резистентности к антибиотикам покрытие ДНКазой Ι может стать своевременным и мощным новым подходом к предотвращению образования биопленок на имплантатах и устройствах из биоматериалов.
Когда биопленка созревает до определенной степени, обработка ДНКазой перестает быть эффективной. Такая резистентность к ДНКазе может быть обусловлена замещением или дополнением эДНК другими компонентами внеклеточного матрикса или связыванием эДНК с другим компонентом, который защищает ее от ферментативной деградации. Поэтому методы ферментативного гидролиза, дестабилизирующие биопленки путем ферментативной деградации эДНК, должны быть направлены также на полисахариды или белки, связанные с эДНК. Например, взаимодействие эДНК с Psl и пилями IV типа играет важную роль в формировании биопленки, и нарушение этих взаимодействий также может стать потенциально интересной мишенью для борьбы с биопленками. Помимо ДНКазы, накопление самой эДНК в биопленках и очагах инфекции может подкислять местную среду.
Кислая среда стимулирует усиленное образование биопленки P. aeruginosa, способствовует более быстрой эволюции бактерий для повышения антибиотикорезистентности и увеличивает экспрессию множества генов, связанных с биопленкой/вирулентностью. Поэтому использование простых рН-буферных агентов наряду с антибиотиками может стать новой стратегией лечения для борьбы с хронической инфекцией в кислых, обогащенных ДНК легких пациентов клиники.
Галлий (Ga)
Недавно ионы Ga продемонстрировали отличную антипсевдомонадную активность и были использованы в качестве нового подхода к лечению биопленок. В предыдущих исследованиях Ga использовался в качестве "троянского коня" для нарушения метаболизма железа у бактерий и использования Fe-стресса в естественных условиях, поскольку Ga имеет ионный радиус, почти идентичный Fe, и многие биологические системы не способны отличить Ga3+ от Fe3+. Хотя Ga3+ химически похож на Fe3+, в отличие от железа, Ga не может быть восстановлен в физиологических условиях, что также подавляет некоторые из его основных функций. Железо не только является необходимым элементом для роста, но и служит сигналом для формирования биопленки. Таким образом, вмешательство в гомеостаз бактериального железа может служить потенциальной терапевтической мишенью, способной блокировать вирулентность P. aeruginosa как в свободноживущем состоянии, так и в состоянии биопленки.
Предыдущие исследования показали, что низкие концентрации Ga ингибируют рост P. aeruginosa и предотвращают образование биопленки. Это ингибирование было опосредовано подавлением транскрипционного регулятора pvdS, а преодоление репрессии pvdS частично защищало бактерии от ингибирующего рост действия Ga. Помимо самого Ga, некоторые комплексы с Ga также могут воздействовать на метаболизм железа P. aeruginosa для ингибирования образования биопленок, например, десферриоксамин-Ga (DFO-Ga) и цитрат Ga (Ga-Cit).
Десферриоксамин (DFO) - это сидерофор на основе гидроксамата, который индуцирует белки, связанные с цитратом железа и поглощением железа DFO в P. aeruginosa, испытывающей недостаток железа. Комплекс DFO-Ga, который может убивать свободноживущие бактерии и предотвращать образование биопленки, был одобрен для клинического применения. Однако последние исследования показывают, что Ga-Cit обладает антибиопленочным эффектом и более бактерициден, чем Ga-DFO (Rzhepishevska et al., 2011). Как и другие комплексы Ga, Ga-Cit значительно ингибировал производство биопленки у P. aeruginosa при концентрации 10 мкМ. Кроме того, в ряде исследований изучалась активность Ga в комбинации с антибиотиками в поисках полезных синергетических эффектов. Было установлено, что нитрат Ga является эффективным антимикробным агентом, который подавляет рост P. aeruginosa. Недавнее исследование показало, что Ga(NO3)3 и тетрациклин по отдельности обладают бактерицидным действием, а их совместное применение сильно подавляет образование биопленки P. aeruginosa (Kang et al., 2021).
Ga3+ эффективен в разрушении бактериальных биопленок, и многие препараты на основе Ga были одобрены для клинического применения с замечательными результатами. Например, Ga(NO3)3, одобренный Управлением по контролю за продуктами и лекарствами США (FDA) для лечения инфекций, может использоваться для лечения как острой, так и хронической пневмонии, вызванной инфекцией P. aeruginosa. Кроме того, Ga и его соединения при совместном применении с антибиотиками достигли замечательных результатов в клиническом лечении. Таким образом, Ga, как мишень для разрушения биопленок, имеет потенциал в разработке более эффективных препаратов для лечения биопленочных инфекций.
Оксид азота
Pseudomonas aeruginosa - это факультативный анаэроб, который может дышать в анаэробных условиях и денитрифицировать в присутствии нитрата и нитрита. Эти способности связаны с вирулентностью бактерий. NO - это радикальная двухатомная газовая молекула, которая при низких концентрациях играет важную сигнальную роль как у эукариот, так и у бактерий. Также было продемонстрировано, что NO является эффективным агентом для разрушения биопленки P. aeruginosa, который создает нитрозативный или окислительный стресс в биопленке и вызывает рассеивание P. aeruginosa и других бактериальных биопленок путем снижения уровня c-di-GMP (Williams and Boon, 2019).
Ранние исследования влияния NO на формирование биопленок показали, что наномолярный NO вызывал рассеивание биопленок у P. aeruginosa и повышал эффективность антимикробных соединений в сочетании с антибиотиками. Этот вывод был подтвержден при клиническом лечении пациентов с муковисцидозом. Однако в другом исследовании было обнаружено, что экзогенное добавление высоких концентраций железа подавляло диффузию NO-индуцированных биопленок и способствовало быстрому прикреплению планктонных клеток, а после добавления хелатных агентов железа диффузия возобновлялась (Zhu et al., 2019). Это не связано с поглощением NO свободным железом, а связано с индуцированным железом клеточным ответом, который привел к увеличению производства экзополисахарида Psl и восстановил диффузию биопленки P. aeruginosa.
Совсем недавно у P. aeruginosa в том же опероне, что и PA1976 (NahK), было обнаружено новое семейство гемовых NO-связывающих белков, названных NO-чувствительными белками (NosP). NahK был идентифицирован как NosP-ассоциированная гистидиновая киназа, и его ранее ассоциировали с регуляцией биопленки (Hossain and Boon, 2017). Эксперименты показали, что NosP связывается с NO, который контролирует фосфорилирование гистидинсодержащего фосфотрансферазного домена, что приводит к рассеиванию биопленки. Однако конкретные игроки, участвующие в этом сигнальном пути, еще не определены.
Хотя NO вызывает особый интерес в связи с его ролью в рассеивании биопленки, этот подход все еще представляет много практических проблем в клинических испытаниях. Например, существующий метод ингаляционной NO-терапии чрезвычайно дорог, в основном из-за сложности обращения с газом и его несовместимости с кислородом, что приводит к образованию токсичного диоксида азота (NO2). Поэтому, хотя бактерицидное действие антибактериальных агентов на инфицированные биопленками участки можно целенаправленно усилить, необходимо также снизить токсичность NO, чтобы его можно было использовать в клинической антибиопленочной терапии. Кроме того, использование NO в комбинации с антибиотиками может усилить NO-опосредованный бактерицидный эффект и улучшить специфичность доставки NO, поэтому применение NO по-прежнему очень перспективно.
Бактериофаговая терапия
Бактериофаги - это естественные бактериальные вирусы и поскольку на них не влияет резистентность к антибиотикам, бактериофаги использовались в качестве терапевтических агентов в ранней клинической практике. С появлением штаммов, резистентных к антибиотикам, фаговая терапия вновь привлекла к себе внимание, и растущее число исследований подтвердило использование бактериофагов в терапии и профилактике в борьбе с резистентными к антибиотикам бактериями. Фаги могут кодировать ферменты, которые разрушают полимеры и подавляют формирование биопленки P. aeruginosa, нарушая внеклеточный матрикс и увеличивая проницаемость, что позволяет антибиотикам достигать внутреннего слоя биопленки. Поэтому все больше исследований используют бактериофаги для разработки препаратов для лечения биопленочных инфекций.
Пути, по которым фаги разрушают биопленки, можно разделить на две категории. Во-первых, фаги могут разрушать структуры биопленки, вызывая синтез ферментов, таких как деполимеразы полисахаридов в P. aeruginosa Полисахаридная деполимераза - это полисахаридная гидролаза, кодируемая бактериофагами, которая может специфически разрушать макромолекулярные углеводы на бактериальной оболочке хозяина. IME180, фаг P. aeruginosa, выделенный из одного из госпиталей, кодирует фермент, разрушающий экзополисахариды, который в высокой степени гомологичен дегликанам и может эффективно разрушать экзополисахариды, подавляя образование бактериальных биопленок хозяина и разрушая сформировавшиеся биопленки.
Помимо гидролаз полисахаридов, бактериофаги также могут продуцировать эндолизины, которые подавляют синтез клеточной стенки бактерий путем гидролиза пептидогликана. Другой способ ингибирования биопленок бактериофагами - выработка ферментов, которые подавляют производство биопленок. В одном из исследований сообщалось, что фаги могут быть генетически модифицированы, чтобы индуцировать синтез лактамазы, подавляющей кворум, тем самым ингибируя образование бактериальной биопленки (Pei and Lamas-Samanamud, 2014). Сконструированный фаг T7, включающий ген AHL-лактоназы aiiA, может гидролизовать ацил AHL и подавлять активность QS у P. aeruginosa, в конечном итоге ингибируя образование биопленки (Whiteley et al., 2017). В отличие от полисахаридных деполимераз, которые могут разрушать один или несколько родственных полисахаридов, фаг T7aiiA может воздействовать на множество бактерий в биопленках смешанных штаммов, а не только на бактерии-хозяева.
Помимо прямого использования в качестве инструмента для уничтожения биопленок, фаги могут также косвенно помогать в других стратегиях уничтожения биопленок. В P. aeruginosa PAO1 нитчатые фаги Pf4 паразитируют естественным образом, интегрируясь в геном, и играют важную роль в вирулентности PAO1, развитии биопленки и сохранении стабильности структуры. Исследования показали, что P. aeruginosa, у которой отсутствует кластер генов, кодирующих филаментофаги Pf4, очень восприимчива к филаментофагам Pf4. Поэтому мы мутировали кластер генов, кодирующих филаментозный фаг Pf4, при конструировании модифицированной бактерии, что сделало ее очень чувствительной к филаментозному фагу Pf4 в биопленках. При контакте нитевидный фаг Pf4 мог инфицировать и лизировать сконструированные бактерии, высвобождая внутриклеточное накопление экзополисахаридных гидролаз PelA и PslG, тем самым разрушая биопленку P. aeruginosa (Wang et al., 2021).
Как упоминалось ранее, бактериофаги считаются потенциальными препаратами для профилактики и борьбы с биопленками благодаря их инфекционному разнообразию и специфичности. Однако применение фагов в борьбе с биопленками все еще имеет некоторые ограничения. Например, снижение метаболической активности бактериальных клеток биопленки вследствие фаговой инфекции зависит от условий роста хозяина и стимулирует быстрое высвобождение бактериальных эндотоксинов, что приводит к воспалительной реакции.
aPDT
Антимикробная фотодинамическая терапия (aPDT) - это новый неинвазивный метод лечения, который использует нетоксичный фотосенсибилизатор (PS), определенные длины волн видимого или ближнего инфракрасного света и молекулярный кислород вокруг или внутри патогенов, чтобы вызвать фототоксические реакции для уничтожения патогенов. aPDT также может разрушать микробные биопленки в процессе, состоящем из двух этапов.
На первом этапе происходит связывание PSs с матрицей биопленки. Хотя некоторые типы PSs связываются только с поверхностью клетки, большинство типов PSs могут проходить через цитоплазматическую мембрану и проникать в цитоплазму. PSs, связывающиеся с матриксом биопленки, генерируют реактивные формы кислорода (ROS) под воздействием света, тем самым инициируя многоцелевое повреждение, которое атакует различные компоненты биопленки, что приводит к дезинтеграции, включая разрушение липидов, белков, ДНК и экзополисахаридов в матриксе. В исследованиях приводится множество примеров использования aPDT в терапии биопленочных инфекций, и некоторые из них были использованы в клинических испытаниях (Tahmassebi et al., 2015; Liang et al., 2020).
Полисахариды являются наиболее распространенными полимерами в матрицах биопленок. В присутствии определенной концентрации Tetra-Py+-Me концентрация полисахаридов в биопленке P. aeruginosa значительно снижалась после облучения, а субстрат биопленки подвергался фотодинамической атаке и разрушался. aPDT, нацеленные на родственные белки, также влияют на формирование биопленки P. aeruginosa. PS метиленовый синий (MB) в сочетании с антибиотиком гентамицином (GN) оказывает синергетический антибактериальный эффект на планктон. Добавление GN в концентрации, при которой MB сам по себе не оказывает значительного антибактериального эффекта, может оказывать положительное бактерицидное действие против биопленок P. aeruginosa. Этот синергический механизм уничтожения может быть вызван тем, что GN действует на уровне синтеза белка, изменяя проницаемость бактериальной стенки и тем самым способствуя накоплению MB, но его потенциальный механизм нуждается в дальнейшем исследовании.
Недавно было продемонстрировано, что антимикробная фототермическая терапия (aPTT) является перспективным методом устранения планктонных клеток и биопленок. Совместное использование aPDT и aPTT также стало эффективной местной заместительной терапией для лечения антибиотикорезистентных бактериальных инфекций и биопленок. В то время как покрытые 3-аминопропилсиланом суперпарамагнитные наночастицы оксида железа не оказывают существенного ингибирующего воздействия на биопленки без лазерной обработки, дополнительная лазерная обработка значительно уменьшает биопленки P. aeruginosa. Более того, после сочетания наночастиц с PS, биопленка может быть снова ослаблена. Такая комбинация наночастиц и PS может улучшить лечение резистентных к препаратам бактерий и их биопленок через двойной механизм aPDT/aPTT (Bilici et al., 2020).
Благодаря своему многоцелевому повреждению микробных клеток и неспособности вызывать лекарственную резистентность, aPDT привлекает все больше внимания в качестве альтернативного лечения и она также эффективна в сочетании с антибиотиками (Feng et al., 2021). Однако применение aPDT имеет определенные ограничения. Ограничение условий светопропускания делает ее более эффективной в клиническом лечении местных инфекций. Кроме того, характеристики PS и соответствующего источника света влияют на его применение. Следует выбирать PS с низким молекулярным весом и высокой проникающей способностью, а также следует учитывать их стоимость (Wainwright et al., 2017).
Выводы и перспективные применения
Помимо вышеупомянутых терапевтических стратегий, существует множество других интересных методов, которые могут быть использованы для ликвидации биопленок P. aeruginosa в клинической практике.
P. aeruginosa сама может вырабатывать сигнальные молекулы, обладающие ингибирующей активностью в отношении сформированной ею биопленки. Например, цис-2-деценовая кислота, короткоцепочечная жирная кислота, вырабатываемая P. aeruginosa, действует как сигнал рассеивания, направленный на биопленку некоторых бактерий. Кроме того, некоторые новые материалы, такие как наночастицы, класс новых антибактериальных агентов, демонстрируют антибактериальный механизм, включающий разрушение бактериальных биопленок, и уже разработано множество инновационных антибиопленочных нанопрепаратов и наноматериалов для клинического лечения.
В одном из недавних исследований была разработана новая фотокаталитическая наносистема бактериофагов с квантовыми точками, которая сочетает фаговую терапию и фотодинамическую терапию, не только специфически связываясь с P. aeruginosa, но и воздействуя на бактерии хозяина благодаря присущей фагам инфекционности, локально генерируя огромное количество ROS при облучении видимым светом и тем самым демонстрируя мощную антибиопленочную активность (Wang et al., 2022).
Однако микроорганизмы адгезируют к поверхностям медицинских устройств и склонны к образованию биопленок, что приводит к неизбежным и сложным проблемам с инфекцией биопленки P. aeruginosa, вызванной использованием клинических медицинских устройств. Модификация поверхности биоматериалов стала предметом обширных исследований, направленных на снижение микробной колонизации и образования биопленок, и была подробно рассмотрена (Yadav et al., 2021). Эффективное антимикробное покрытие поверхности может предотвратить адгезию P. aeruginosa, обеспечивая антибиопленочный эффект. В одном исследовании была достигнута нулевая адгезия биопленки P. aeruginosa путем добавления смазочных жидкостей, состоящих из перфторированных жидкостей, в пористый политетрафторэтилен (ПТФЭ) для изготовления поверхностей, пропитанных жидкостью (Epstein et al., 2012). Кроме того, производство биопленок P. aeruginosa сократилось на четыре порядка после использования скользящей омнифобной ковалентно присоединенной жидкой поверхности по сравнению с полидиметилсилоксаном (PDMS), широко используемым материалом для медицинских имплантатов (Zhu et al., 2022). Эта устойчивая к биопленке жидкостная поверхность обеспечивает новую стратегию лечения биопленок P. aeruginosa.
Помимо P. aeruginosa, существует множество микроорганизмов, вызывающих заболевания, связанные с биопленками, такие как Staphylococcus aureus, Candida albicans и Mycobacterium tuberculosis, которые вызывают серьезные глобальные проблемы со здоровьем из-за их резистентности к антимикробным препаратам. Быстрая разработка новых противомикробных препаратов для преодоления резистентности является неотложной задачей, и получение информации о конкретных механизмах возникновения биопленок и их взаимодействии с хозяином является ключом к решению этой проблемы. Хотя биопленки изучаются с помощью геномики, протеомики и секвенирования РНК, быстрая эволюция микроорганизмов опережает темпы развития терапевтических технологий. Необходимы новые технологии для мониторинга формирования биопленок и реакции биопленок на антибиотикотерапию. Кроме того, прямое уничтожение становится затруднительным, поскольку патогены развивают защиту против антимикробных агентов, и подавление вирулентности бактерий может быть более эффективным, чем их уничтожение, что также открывает новые возможности для лечения инфекций, вызванных биопленками.