В новом исследовании, опубликованном в журнале The Lancet Microbe, сообщается о влиянии микробиома кишечника новорожденных на эффективность вакцин.
Наиболее уязвимым сегментом населения в отношении большинства инфекционных заболеваний являются маленькие дети, особенно в возрасте до пяти месяцев, проживающие в странах с низким и средним уровнем дохода. К сожалению, в этих регионах низкий уровень иммунизации и часто отмечается низкая эффективность вакцин, как это наблюдается, например, в случае с пероральными ротавирусными вакцинами. В то время как эти вакцины защитили почти 100% маленьких детей в Финляндии, подобное наблюдалось менее чем у 60% и 50% детей Никарагуа и Бангладеш, соответственно. Такое же снижение защиты наблюдалось и с вакциной БЦЖ: в Европе показатели защиты достигали 100%, в то время как в Африке они составляли 0-50%.
Среди факторов, влияющих на реакцию на вакцину, особое значение имеют возраст, генотип, пол и анемия. На долю генетики может приходиться до 40% различий между ответами на вакцинацию.
Помимо этих внутренних факторов, внешние факторы, такие как состав вакцины, условия хранения, история предыдущего контакта с патогеном, хроническое воспаление и состояние питания, также играют важную роль в вакцинальном ответе.
В настоящем исследовании изучалась роль микробиома кишечника в раннем возрасте в иммунологическом созревании и функционировании. На это влияет уровень гигиены, рацион питания и другие факторы окружающей среды как матери, так и ребенка. Так, например, новорожденные в африканских общинах демонстрируют особый микробный профиль по сравнению с детьми из западных обществ.
Важно отметить, что эти различия связаны со снижением эффективности вакцин, что может частично объяснять разницу в эффективности вакцин в разных географических регионах и у разных людей. Понимание и преодоление этих ограничений может помочь избежать использования адъювантов для повышения иммуногенности вакцин, поскольку адъюванты часто небезопасны, вызывают дополнительные побочные эффекты и способствуют увеличению затрат на исследования вакцин и сами вакцины.
На микробиом кишечника и иммунологический ответ на вакцинацию влияют схожие факторы, что указывает на их сильную взаимозависимость друг от друга. К ним относятся способ родоразрешения, преждевременные роды, грудное вскармливание по сравнению с питанием молочными смесями, применение антибиотиков или пробиотиков, а также гигиена. Например, при вагинальных родах младенцам попадают материнские микробы, преимущественно видов Escherichia, Lactobacillus, Bacteroides и Bifidobacterium, которые колонизируют кишечник младенца. После кесарева сечения происходит колонизация кишечника кожными и внутрибольничными бактериями, в результате чего доминируют виды стрептококков, стафилококков и энтерококков. Антибиотики подавляют этот процесс, тем самым повышая риск аберрантного иммунологического созревания и аутоиммунных или атопических заболеваний.
Грудное вскармливание также обеспечивает многочисленные питательные, иммунологические и антимикробные факторы, которые поддерживают развитие микробиома кишечника младенца. Например, некоторые молочные сахара в человеческом молоке способствуют колонизации Bifidobacterium. Благодаря этому около 80% микробиома кишечника детей, находящихся на грудном вскармливании, состоит из Bifidobacterium, по сравнению с 5-30% у детей, находящихся на молочных смесях. Кроме того, при переваривании этих сахаров образуются короткоцепочечные жирные кислоты (КЦЖК), которые жизненно необходимы для развития иммунной толерантности.
Грудное молоко также способствует инокуляции кишечника другими микроорганизмами из его микробиома. Когда дети отвыкают от грудного молока, в микробиом кишечника новорожденных могут попасть другие виды, такие как Akkermansia и Ruminococcus. КЦЖК имеют ряд преимуществ, поскольку они являются источником энергии для эпителиальных клеток кишечника, поддерживают эпителиальный барьер слизистой оболочки, модулируют метаболизм клеток кишечника, предотвращают избыточный рост патогенов и действуют как сигналы в рамках регуляторных путей в кишечнике и системных иммунных путей. Ацетат, пропионат и бутират являются наиболее распространенными КЦЖК в микробиоме кишечника новорожденных.
КЦЖК стимулируют иммунные клетки, как врожденные, так и адаптивные, увеличивают количество регуляторных Т-клеток (Tregs) в слизистой оболочке и снижают аутоиммунную активность. Более того, эти жирные кислоты способствуют переключению классов в ответе антител с созреванием антиген-реагирующих В-клеток и стимулируют дифференцировку плазматических клеток путем воздействия на сигнальные пути в дендритных клетках. Другой механизм защиты, например от гриппа А, может быть связан с связыванием КЦЖК рецептора 43 (G-protein-coupled receptor 43, GPR43), который ингибирует проникновение вируса, блокируя его корецептор.
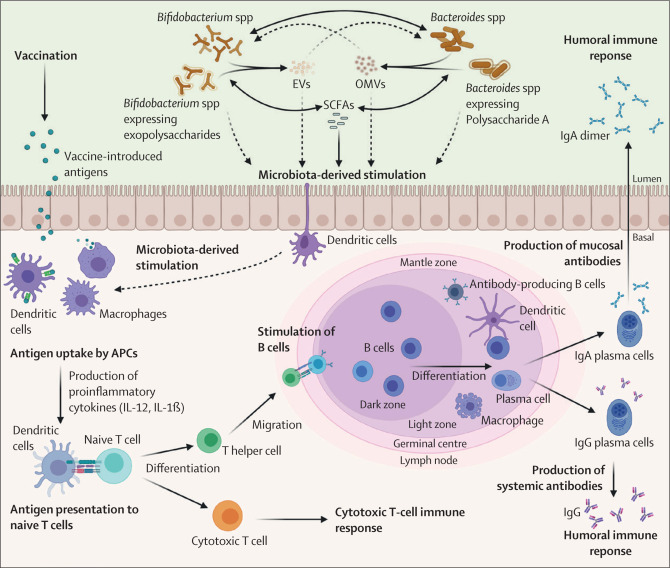
Комменсалы микробиоты кишечника Bifidobacterium, Bacteroides и их микробные продукты обладают иммуномодулирующими свойствами, которые могут влиять на результаты вакцинации в раннем возрасте.
Микробиом кишечника также обеспечивает бактериальные внеклеточные везикулы (BEVs) и экзополисахариды, которые оказывают свое уникальное воздействие на иммунитет хозяина или открывают новые подходы к вакцинации. BEVs могут активировать иммунные клетки и стимулировать их к иммунному ответу на клетки, которые их произвели. BEVs также могут быть использованы для прямого переноса частиц вакцины в клетки слизистой оболочки без необходимости инъекций, поскольку они не реплицируются в организме хозяина, стабильны при температуре тела и устойчивы к разрушению в присутствии многих ферментов и кислого рН. Использование BEVs может снизить стоимость производства и введения вакцин и их неблагоприятные последствия, обеспечивая при этом естественный адъювантный эффект, который повышает эффективность вакцин. Успех уже созданной BEV-вакцины против холеры и менингита типа B, а также многообещающие результаты использования комменсальных BEV-носителей антигенов против чумы и гриппа могут привести к созданию нового поколения вакцин на основе иммуномодулирующих BEV комменсального происхождения с высокой эффективностью и стандартами биобезопасности в глобальном масштабе.
Микробиота кишечника усиливает адаптивный иммунный ответ на вакцины, стимулируя развитие и созревание В- и Т-клеток. В конечном итоге это способствует формированию богатых лимфоидными клетками Пейеровых бляшек в тонком кишечнике, выработке интерферона I типа и антиген-специфическому ответу Т-клеток. Эксперименты на животных показали, что нарушение нормального микробиома кишечника младенца ухудшает реакцию антител как на вакцины, содержащие адъюванты, так и на живые аттенуированные вакцины. Однако это можно обратить вспять путем введения определенных штаммов Escherichia coli или трансплантации фекальной микробиоты.
Состав микробиома кишечника связан с дифференцированным ответом на вакцины, причем различные микробы действуют по-разному в зависимости от уровня их численности. Например, раннее обилие бифидобактерий усиливало раннюю и позднюю реакцию на вакцины против столбняка, БЦЖ и полиомиелита у детей из Бангладеш в течение двух лет. Новорожденные из стран с низким и высоким уровнем дохода, которые одинаково реагировали на вакцины, имели схожие профили микробиома кишечника, например, меньшее количество бактерий Bacteriodetes и большее количество Clostridium cluster XI или Proteobacteria.
Пробиотики и пребиотики способствуют укреплению здоровья хозяина посредством воздействия на микробиом. Эти добавки могут также усиливать рост полезных видов, таких как Bifidobacterium и Lactobacillus, что приводит к увеличению выработки КЦЖК. У младенцев в возрасте до четырех месяцев как пре-, так и пробиотики успешно повышали гуморальный ответ на ряд вакцин, включая полиомиелит, дифтерию, ротавирус и грипп, по сравнению со взрослыми. И наоборот, испытания на взрослых показали, что после истощения этих микроорганизмов, вызванного антибиотиками, вакцинный ответ снижался или не улучшался.
У крыс определенные виды Bifidobacterium вызывают специфические иммуномодулирующие эффекты, такие как восстановление функции Tregs с последующим снижением уровня воспалительных цитокинов, индуцирование благоприятного профиля T-клеток, стимулирование дифференцировки Treg, усиление цитотоксической активности CD8 T-клеток при сохранении активности CD4 T-клеток, а также улучшение B-клеточного и противовирусного иммунного ответа. Один из метаболитов, серпин, обезвреживает воспалительные протеазы. Численность бифидобактерий связана с уровнем актинобактерий, что, в свою очередь, влияет на иммунный ответ, вызванный вакциной. Другие важные бактерии, модулирующие вакцинный ответ, включают Bacteroides, которые доминируют в кишечнике взрослого человека, причем один конкретный штамм вырабатывает естественный липоолигосахаридный адъювант, более безопасный, чем адъювант E. coli.
Более глубокое понимание и характеристика ключевых штаммов микробиома здорового новорожденного может привести к появлению нового поколения безопасных, безыгольных и экономичных методов стимулирующей вакцинации, идеально подходящих для использования в странах с низким и средним уровнем дохода. Эти альтернативные подходы к вакцинации также могут быть использованы для усиления реакции на иммуногенные компоненты с учетом их профиля безопасности, что может ускорить исследования вакцин и снизить затраты. Кроме того, такие вакцины могли бы способствовать разработке новых и усовершенствованных методов иммунизации.

