Современные представления о патогенезе атеросклероза предполагают, что он представляет собой хроническое субклиническое воспаление, вызванное липопротеином низкой плотности - окисленным холестерином (oxLDL).
Воспаление играет ключевую роль как в начальном развитии липидной атеромы, так и в ее трансформации в уязвимую коронарную атерому, склонную к разрыву. Экспериментальные данные свидетельствуют о том, что важным этапом воспаления внутри коронарной атеромы является генерация иммунного ответа против oxLDL и его основного эпитопа, фосфохолина. OxLDL распознается врожденной иммунной системой с помощью кодируемых герминальной линией рецепторов распознавания паттернов, включая TLR («толл-подобные рецепторы»).
Интересно, что, несмотря на то, что фосфохолин является основным эпитопом oxLDL, он также обнаруживается на различных бактериях, таких как Streptococcus pneumoniae, в которых фосфохолин является важным компонентом липотейхоевой кислоты, входящей в состав полисахаридов клеточной стенки. Хотя TLR2 и TLR4 с их корецептором CD14 первоначально были обнаружены как ключевые компоненты молекулярного механизма, ассоциированного с патогенами, который распознает грамположительные и грамотрицательные бактерии, они также идентифицируют широкий спектр эндогенных структур, включая oxLDL. Сигнализация TLR инициирует выработку цитокинов путем активации транскрипционного фактора NF-kB (ядерный фактор-kappa B) через его адаптерный белок MyD88 (белок первичного ответа миелоидной дифференцировки). Таким образом, иммунные реакции, которые развились для борьбы с бактериальными инфекциями, совпадают с реакциями, участвующими в иммунном ответе на эндогенные воспалительные компоненты атерогенеза.
Возможность участия инфекционных агентов в хроническом воспалении коронарных бляшек рассматривается уже давно. Сообщения конца 1980-х годов о связи антител к хламидиям и хронических стоматологических инфекций с инфарктом миокарда (ИМ) значительно повысили научный интерес к инфекционной гипотезе, которая впоследствии проверялась в крупных долгосрочных испытаниях антибиотиков. Большинство этих испытаний закончились неудачей, поскольку перорально вводимые бактерицидные антибиотики, эффективные против Chlamydia pneumoniae и пародонтальных бактерий, не привели к снижению частоты вторичных сердечно-сосудистых событий. Были также опубликованы противоречивые результаты менее масштабных испытаний. В настоящее время известно, что хроническое воспаление часто вызвано бактериальными биопленками, которые могут ускользать от врожденной иммунной системы и быть устойчивыми к антибиотикам, что, вероятно, может объяснить неудачу испытаний. Дремлющие биопленки могут активироваться некоторыми малоизвестными факторами, вызывая производство нового поколения вирулентных бактерий, которые освобождаются из биопленки.
Используя широкоспектральную полимеразную цепную реакцию (ПЦР) 16-S рДНК с последующим клонированием и секвенированием, в 2005 году мы обнаружили, что коронарные атеромы, полученные при вскрытии, содержали ДНК стрептококков группы viridans, а также других видов бактерий, обычно встречающихся в полости рта. ДНК стрептококков группы viridans также была обнаружена в большинстве аспиратов тромбов у пациентов с ИМ, в разорванных церебральных аневризмах, в аспиратах тромбов у хирургических пациентов с тромбозом артерий и глубоких вен нижних конечностей, а также в церебральных тромбах у пациентов с острым ишемическим инсультом, подвергшихся тромбэктомии; в последней серии наличие стрептококков viridans было также подтверждено бактериальной иммуногистохимией.
Наличие ДНК стрептококков viridans было также подтверждено другими исследованиями. Недавний подход, основанный на использовании метагеномных исследований с секвенированием гена 16S рРНК, показал, что атеросклеротические бляшки содержат ДНК-последовательности десятков или даже сотен бактерий, обитающих в полости рта, кишечнике, на коже или в окружающей среде, что свидетельствует о наличии микробиома. Однако эти последовательности в основном присутствуют в незначительных долях (<1 %), и большинство из них, скорее всего, переносятся одиночными или небольшими группами фагоцитов или являются контаминациями от реагентов ПЦР и другого лабораторного оборудования или элементов окружающей среды, не имеющими клинического значения.
Стрептококки группы viridans являются безвредными комменсалами в полости рта, где они выступают в качестве первоначальных колонизаторов при развитии биопленки зубов, известной как зубной налет. Однако было обнаружено, что они являются основным видом бактерий, обнаруживаемых в крови после удаления зубов и других стоматологических процедур, и считаются одними из наиболее распространенных патогенных агентов инфекционного эндокардита, который является типичным примером хронической бактериальной инфекции, вызванной бактериальной биопленкой.
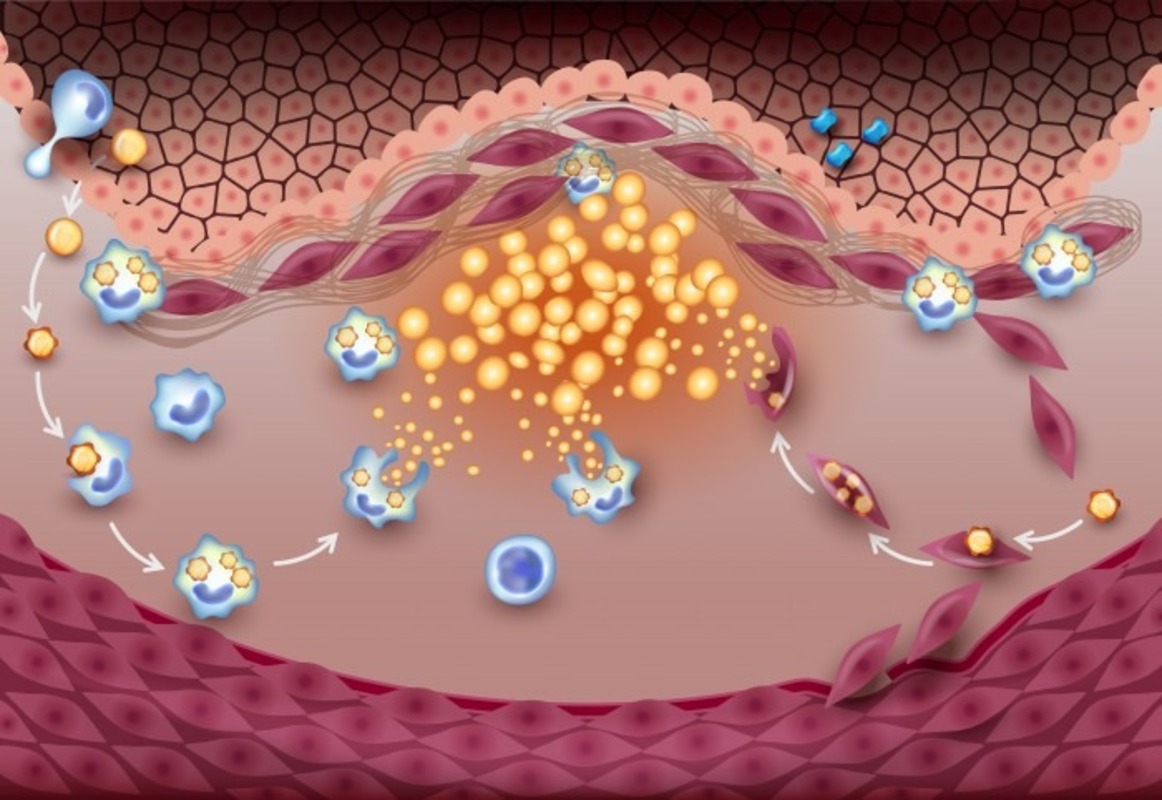
Главный вопрос заключается в причинно-следственной связи: играют ли бактерии, обнаруживаемые в атеросклеротических бляшках, какую-либо причинную роль в развитии бляшек, или же они или их ДНК присутствуют в результате воспаления? Чувствительные молекулярные зонды могут обнаруживать бактериальную ДНК, поглощенную фагоцитарными клетками, также происходящими из несердечных участков, таких как дёсны, кожа, дыхательные пути или кишечник. Бактерии могут прикрепляться в виде биопленки к неровной поверхности бляшек после преходящей бактериемии, не имеющей патогенного значения. При реальной инфекции вторжение патогена активирует врожденную иммунную систему, и должны быть доказательства присутствия возбудителя в атеросклеротической бляшке, но не в нормальных кровеносных сосудах. В исследовании на основе аутопсии данная концепция может быть развита путем изучения того, связано ли присутствие бактерий в коронарной атероме с разрывом и тромбозом атеромы и со смертью от ИМ. В этой ситуации отсутствие бактерий должно ассоциироваться с нормальной артерией или неразорванной атеромой и с некоронарной причиной смерти.
В настоящем исследовании мы ставили целью изучить роль бактерий полости рта, в частности стрептококков viridans, и врожденной иммунной системы в воспалении атеросклеротических бляшек, а также исследовать их роль в качестве фактора риска развития фатального ИМ. Это было достигнуто путем первоначального анализа наличия и распространенности ДНК бактерий полости рта в атеромах с помощью количественной ПЦР в реальном времени (RT-qPCR) и применения бактериальной иммуногистохимии в уникальной серии пациентов, перенесших внезапную внебольничную смерть.
Затем мы использовали стимулированные бактериями клеточные линии TLR для изучения in vitro, какие сигнальные пути TLR предпочитают активировать стрептококки и другие бактерии-кандидаты. Далее мы провели иммуногистохимический анализ, чтобы определить, сопровождается ли коэкспрессия рецепторов сигнальных путей TLR бактериальной иммунопозитивностью в разорванных фиброзных капсулах коронарных атером и активируется ли при этом адаптивная иммунная система. Чтобы подтвердить результаты наших исследований на случаях аутопсии, мы также изучили наличие геномов оральных бактерий и бактериальной иммунопозитивности в серии образцов атеросклеротической эндартерэктомии от хирургических пациентов. С этими образцами пациентов мы провели анализ полногеномной экспрессии (GWE) атеросклеротических бляшек, чтобы изучить повышение или понижение экспрессии генов в TLR-зависимых сигнальных путях для распознавания бактерий.
Из обнаруженных бактерий наиболее распространенной была ДНК стрептококков группы viridans, которая была обнаружена в 42,1% коронарных бляшек и 42,9% эндартерэктомий. Иммунопозитивность к стрептококкам viridans коррелировала с тяжелым атеросклерозом в обеих сериях и смертностью от ишемической болезни сердца или инфаркта миокарда. Стрептококки viridans колонизировали ядро атеромы в виде биопленки, не распознаваемой макрофагами врожденной иммунной системы. Напротив, иммунопозитивные стрептококки, которые, по-видимому, происходили из биопленки, проникали в разорванную фиброзную капсулу атеромы в образцах эндартерэктомии и коронарных бляшках и были обнаружены рецепторами, распознающими паттерны, и коэкспрессировались с адаптивным иммунным ответом. Среди штаммов стрептококков viridans TLR2 был наиболее активированным бактериальным сигнальным путем. Анализ экспрессии генома образцов, полученных при эндартерэктомии, показал повышенную экспрессию путей распознавания бактерий.
Таким образом, латентное хроническое бактериальное воспаление ускользает от иммунного обнаружения и может способствовать патогенезу осложненных атеросклеротических бляшек и фатального инфаркта миокарда.