46-летний мужчина с муковисцидозом и трансплантацией легких за два года до этого поступил в стационар с болью в груди и кровохарканьем.
Недавно пациенту был поставлен диагноз COVID-19, а КТ грудной клетки выявила множественные округлые помутнения с центральной кавитацией. Поскольку визуализация не соответствовала легочной форме COVID-19 и не было выявлено явного риска развития туберкулеза, была проведена бронхоскопия с трансбронхиальной биопсией. Ткани и бронхиоальвеолярная лаважная жидкость были собраны и переданы в микробиологическую лабораторию для анализа.
Вирусная этиология, включая грипп A/B, парагрипп 1-3, аденовирус, RSV и метапневмовирус, была исключена с помощью молекулярных исследований. Галактоманнан в БАЛ был отрицательным, как и культуры грибов и микобактерий, а также ПЦР на Mycobacterium tuberculosis. Окрашивание биоптата по Грокотту было отрицательным, но отмечались организующаяся пневмония и мононуклеарный инфильтрат. У пациента в анамнезе была рецидивирующая инфекция Pseudomonas aeruginosa с множественной лекарственной резистентностью, и он получал эмпирическое лечение цефтазидимом/авибактамом.
Лабораторная идентификация
Окраска по Граму тканей и БАЛ в целом была ничем не примечательна. Гистопатологический анализ трансбронхиальной ткани выявил изменения, свидетельствующие об организующейся пневмонии с мононуклеарным инфильтратом (изображение 2, слева). Бактериальный рост преобладающего микроорганизма как из БАЛ, так и из биопсийной ткани наблюдался через 48 часов на кровяном и шоколадном агарах, но отсутствовал на агаре МакКонки. Через 96 часов колонии микроорганизмов стали мукоидными, слегка розовыми и объединенными (изображение 1, справа). Окрашивание роста по Граму выявило короткие, плохо окрашивающиеся грамположительные коккобациллы, имеющие вид бисеринок. Из-за неполного окрашивания по Граму этого изолята была предпринята попытка модифицированного окрашивания, которая оказалась положительной (изображение 1, слева). Организм был как каталазо-, так и уреазоположительным. Впоследствии изолят был идентифицирован с помощью MALDI-TOF MS как Rhodococcus equi, и пациент был выписан, принимая имипенем и линезолид.
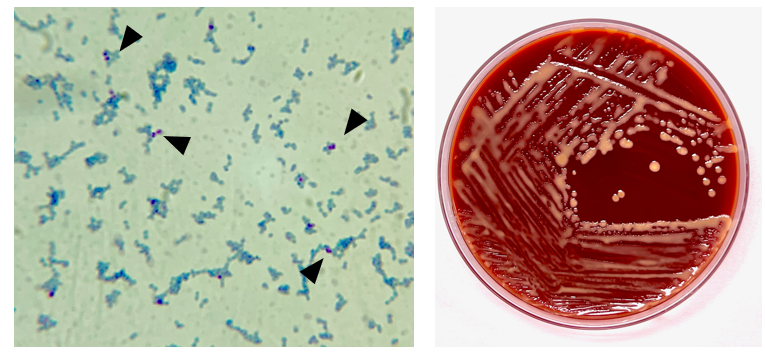
Изображение 1. Слева - модифицированное окрашивание кислотоустойчивых бактерий, выявляющее мелкие коккобациллы (черные стрелки). Справа - характерные мукоидные колонии изолята лососевого цвета на кровяном агаре после 96 часов инкубации.
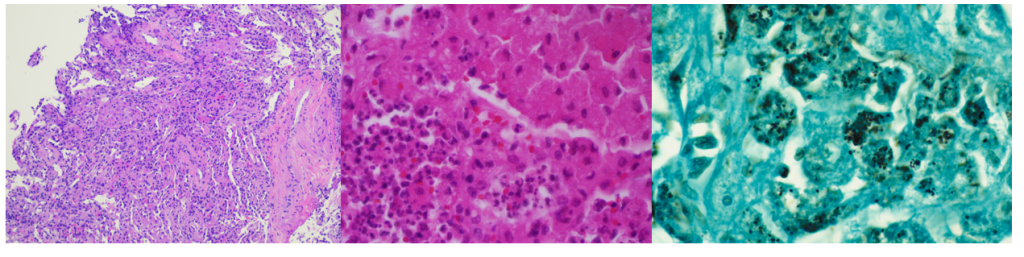
Изображение 2. Слева - трансбронхиальная биопсия, выявляющая участки агрегации гистиоцитов и мононуклеарный инфильтрат (10-кратное увеличение). По центру - репрезентативное изображение разросшихся гистиоцитов с маленькими, бледно окрашенными круглыми формами на фоне нейтрофилов (увеличение 40X). Справа - репрезентативное изображение гистиоцитов, заполненных кокковидными и коккобациллярными формами (увеличение 40X).
Обсуждение
Rhodococcus equi является зоонозным патогеном, который в первую очередь вызывает инфекции среди иммунокомпрометированных хозяев. Нечасто выделяемый клинически, этот микроорганизм является частым патогеном у лошадей, вызывая пневмонию с образованием абсцессов, часто с распространением на периферические участки из-за высокой нагрузки на организм. Организм выделяется с фекалиями инфицированных животных, что приводит к загрязнению почвы на фермах и других сельскохозяйственных угодьях, где организм либо аэрозолируется и вдыхается, либо приобретается путем прямой инокуляции.
Хотя заражение человека классически связывают с контактом с лошадьми или окружающей средой, растет количество литературных данных, свидетельствующих о том, что многие пациенты с микробиологически доказанными случаями инфекции R. equi не подвергались такому воздействию окружающей среды. Этот пациент относится к последней категории, у него не было контакта с домашним скотом.
R. equi является представителем аэробных актиномицетов. Как и у Nocardia sp., клеточная стенка R. equi содержит миколовые кислоты, которые приводят к положительной реакции при окрашивании модифицированным кислотоустойчивым красителем. Организм является факультативным, внутриклеточным патогеном, живущим в макрофагах и гистиоцитах, что приводит к гранулематозному воспалению и в конечном итоге к некрозу.
Иммуносупрессия (включая ВИЧ-инфекцию или иммуносупрессивную терапию) является основным фактором риска заражения R. equi, поскольку большинство клинических случаев зарегистрировано именно в этих условиях. У иммунокомпрометированных хозяев спектр проявлений R. equi разнообразен, но чаще всего (около 80%) включает поражение легких с полостной пневмонией верхней доли. С инфекцией R. equi может быть связана характерная малакоплакия (инфильтрация пенистых гистоцитов с внутриклеточными бактериями и базофильными включениями, называемыми тельцами Михаэлиса-Гутмана). В случае данного пациента эти структуры отсутствовали, несмотря на наблюдаемую агрегацию гистоцитов и мононуклеарный инфильтрат (изображение 2, центр, слева).
R. equi пневмония среди реципиентов трансплантатов солидных органов, как у пациента в данном случае, ассоциируется с низкой общей заболеваемостью и летальностью, но требует длительных режимов антибиотикотерапии. Тестирование на чувствительность оправдано для руководства терапией R. equi из-за непредсказуемых моделей резистентности среди изолятов. Изолят этого пациента оказался чувствительным к амоксициллину/клавуланату, цефтриаксону, имипенему, ципрофлоксацину, моксифлоксацину, кларитромицину, амикацину, тобрамицину, миноциклину, триметоприму/сульфаметоксазолу, ванкомицину, линезолиду и рифампину. Пациент был выписан, принимая имипенем/линезолид. Во время последующего наблюдения клиническое состояние пациента улучшилось, симптомы прошли, но рентгенологические отклонения сохранились, поэтому он продолжал получать пероральную терапию моксифлоксацином и миноциклином.
