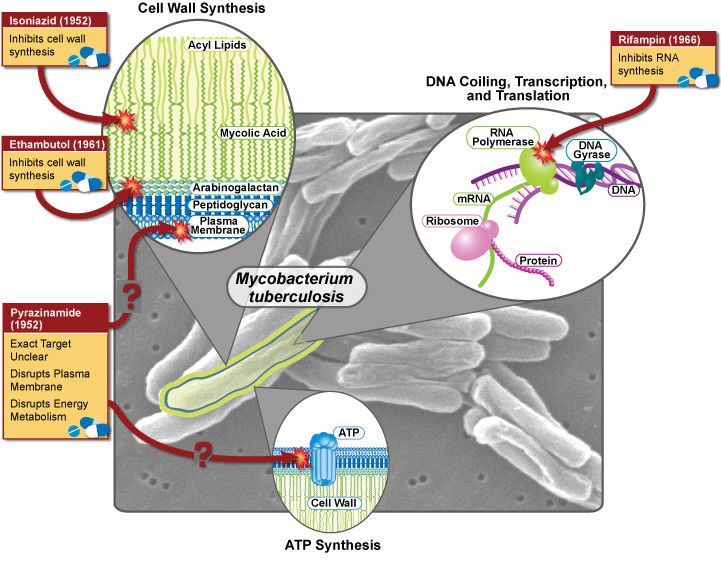
Исследователи выявили важнейший механизм, позволяющий бактериям приобретать резистентность к антибиотикам.
Полученные результаты предлагают потенциальную новую мишень для разработки новых эффективных антибиотиков. В ходе исследования были изучены хинолоны, антибиотики, которые используются для лечения целого ряда бактериальных инфекций, включая туберкулез. Хинолоны работают путем ингибирования бактериальных ферментов: гиразы и топоизомеразы IV, тем самым предотвращая репликацию ДНК и синтез РНК.
В ходе предыдущих исследований был выявлен механизм резистентности, вызванный выработкой пентапептидных повторяющихся белков (PRPs) - семейства молекул, которые также действуют в качестве ингибиторов ДНК-гираз. Один из них, называемый MfpA, обеспечивает хинолон-резистентность Mycobacterium tuberculosis.
Исследователи поставили перед собой задачу выяснить, как PRPs, такие как MfpA, работают на молекулярном уровне. Они очистили MfpA , выделенный из Mycobacterium smegmatis, и показали, что он может ингибировать ДНК-гиразу, мишень хинолонов в микобактериях, тем самым защищая бактериальную клетку от антибиотиков.
Используя рентгеновскую кристаллографию, исследователи показали, что MfpA связывается с АТФазным доменом гиразы, что объясняет его способность предотвращать действие хинолонов.
"Мы не ожидали, что механизм действия MfpA будет таков, это уникальный механизм", - отметил Тони Максвелл, соавтор данного исследования. "Мы надеемся, что это понимание поможет в продвижении новых идей по разработке антибиотиков среди ученых и специалистов фармацевтической промышленности", - добавил он.
Дальнейшая исследовательская работа будет включать в себя молекулярное моделирование на основе структуры MfpA-гиразы для создания малых молекул, которые могли бы имитировать это взаимодействие, и предоставить больше информации о том, как оно работает.