Короткие пептиды могут самостоятельно собираться в сетевидные структуры, которые убивают бактерий. Теперь исследователи выяснили, как контролировать и усиливать эту способность.
Ученый-фармаколог Рэйчел И (Rachel Ee) из Национального университета Сингапура разработала короткие пептиды, которые могут самостоятельно сплетаться в микроскопические сети, улавливающие и убивающие бактерии. Ранее И и коллеги показали, что эти пептиды могут собираться в сети в присутствии бактерий, вероятно, потому, что они распознают молекулы на мембранах бактериальных клеток. В недавнем исследовании ученые продемонстрировали, как небольшие изменения в структуре этих пептидов могут изменить их способность улавливать и убивать бактерии. Их работа, опубликованная в журнале Small, может предоставить новый набор инструментов для борьбы с бактериями, устойчивыми к антибиотикам.
“Это интересное исследование, которое раскрывает правила того, какие [пептидные] последовательности и параметры регулируют захват и уничтожение бактерий”, - отмечает Шуичи Такаяма, инженер-биомедик из Технологического института Джорджии, который не принимал участия в исследовании. “Устойчивость к антибиотикам не исчезнет в ближайшее время, поэтому все, что можно добавить в арсенал, я думаю, будет полезно”.
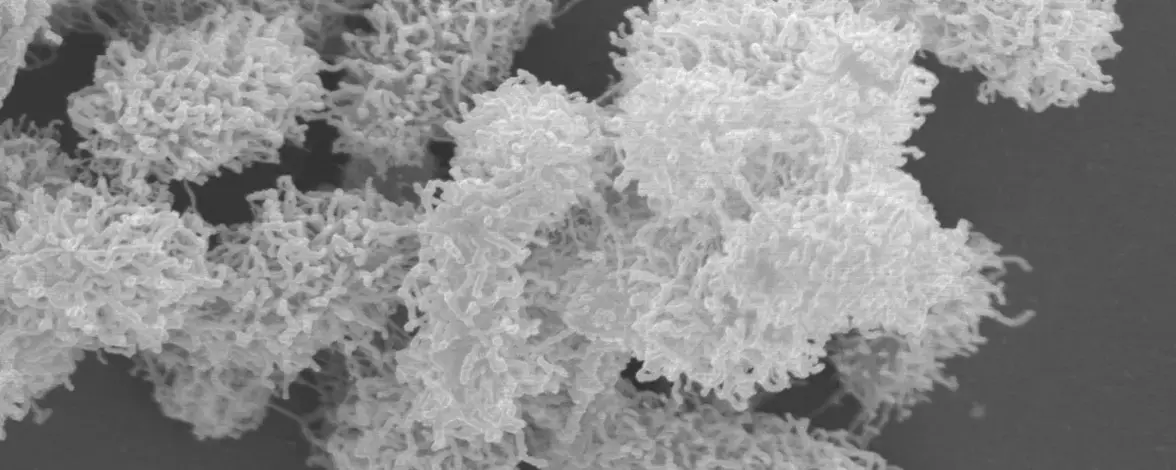
Группа И разрабатывает короткие, похожие на шпильки антимикробные пептиды, содержащие от 10 до 15 аминокислот, которые убивают бактерии, проделывая отверстия в их мембранах. В исследовании, проведенном в 2021 году, исследователи разработали 10 таких пептидов, чтобы изучить различия в их способности воздействовать на бактерии. Обычно эти пептиды существуют в виде отдельных спиралей, но исследователи заметили, что один пептид неожиданно сформировал сетчатую структуру, которую они назвали наносетью. “Сначала мы подумали, что это ошибка”, - рассказывает И. Ученые посчитали, что неожиданная структура возникла из бактерий, но когда они культивировали бактерии отдельно или в присутствии других девяти пептидов, наносеть не образовалась. Это подтвердило, что эти структуры сформировал пептид, а не бактерии.
И наоборот, исследователи обнаружили, что пептид образует наносети только в присутствии бактерий, в частности, реагируя на липополисахариды и липотейхоевую кислоту, отрицательно заряженные молекулы, из которых состоят мембраны грамотрицательных и грамположительных бактерий соответственно. Тот факт, что способность пептидов к самосборке зависит от присутствия бактерий или, по крайней мере, их компонентов, указывает на их потенциал в качестве антимикробного средства.
Ранее группа И обнаружила, что они могут превратить пептид, не образующий наносеть, в пептид, способный образовывать наносеть, введя три аминокислоты - лейцин, треонин и аланин - в конце "шпильки". В настоящем исследовании авторы решили узнать, может ли последовательность пептидов также влиять на архитектуру наносети, например на то, насколько плотно структуры обволакивают бактерии. Они обнаружили, что пептиды с более объемными ароматическими остатками, такими как фенилаланин и триптофан, образуют плотные нанорешетки. Данные электронной микроскопии показали, что наносеть, образованная одним из этих пептидов, даже умудрялась индивидуально упаковывать каждую бактерию, как тщательно завернутый подарок, прежде чем убить их. С другой стороны, пептиды с большим количеством отрицательно заряженных остатков, такие как глутаминовая кислота, образовали свободные наносетки, которые захватывали сразу несколько бактерий, но не могли их уничтожить. “Мы до сих пор не знаем, какой тип сетей лучше, но теперь у нас есть возможность проектировать сети различной морфологии для различных применений”, - поясняет И. “Существует целый набор аминокислот и химических модификаций, которые мы можем внести в структуру пептида, чтобы смешивать и сочетать их, как в конструкторе Lego”.
И говорит, что исследователи в этой области обычно разрабатывают антимикробные пептиды для лечения местных инфекций, поскольку “на поверхности [тела] все еще много инфекций, с которыми мы не можем эффективно бороться”. Но в будущем люди, возможно, смогут принимать пептиды, образующие наносети, перорально, как только исследователи решат проблемы их потенциальной стабильности и токсичности. “Пептиды короче, поэтому у них больше шансов достичь цели при пероральном применении”, - отмечает Такаяма.
Такаяма полагает, что использование пептидов наряду с антибиотиками, вероятно, является более перспективным, и оказалось, что прогресс в этой области уже наметился. Группа И недавно обнаружила, что бактерии, которые когда-то были пойманы в ловушку наносетей, могут претерпевать генетические изменения, которые снижают их общую приспособленность, даже после того, как они были освобождены. Поскольку менее приспособленные бактерии, вероятно, более восприимчивы к уничтожению антибиотиками, это говорит о том, что наносети могут помочь преодолеть резистентность, воздействуя на бактерии уже существующими антибиотиками. И сообщила, что в настоящее время эта работа рассматривается для публикации. Группа И также пытается разработать еще более короткие пептиды, образующие наносети.
“Короче - значит дешевле, а более дешевое средство подходит для применения в клинике”, - говорит И. “Я думаю, что это очень важно".