Рак легких является наиболее распространенным видом рака и основной причиной смертности от рака во всем мире, составляя примерно один из десяти диагностированных случаев рака и один из пяти случаев смерти от рака.
Микробиом, состоящий из бактерий, грибов, архей и вирусов, становится ключевым фактором в развитии и лечении рака и может служить потенциальным диагностическим или прогностическим биомаркером. Исследования показали, что микробиом играет решающую роль в канцерогенезе, прогрессировании опухоли и ответе на терапию различных типов опухолей, влияя на исход заболевания. Например, было установлено, что легочная симбиотическая микробиота, активируя γδ Т-клетки, которые находятся в легких, и вырабатывая несколько эффекторных молекул, способствует воспалению, связанному с пролиферацией клеток аденокарциномы легких. Устранение симбиотических бактерий значительно улучшает прогноз этого вида рака.
Также было продемонстрировано, что модели, включающие многокомпонентную микробиоту кишечника, значительно повышают точность диагностики колоректального рака в различных когортах. Более того, микробиота может взаимодействовать с другими хорошо известными факторами хозяина, включая воспаление опухоли, иммунную деструкцию и нестабильность генома, влияя на устойчивость к противораковым препаратам.
С другой стороны, существует тесная связь между воспалением и дисбалансом микробиоты в процессе развития рака легких. Микробиота мокроты у никогда не куривших больных раком легких отличается от контрольной. Пациенты с немелкоклеточным раком легких отвечают на Streptococcus salivarius и Streptococcus agalactiae значительно большим количеством Т-хелперов 17-го типа (Th17) и Т-хелперов 1-го типа (Th1). В случаях плоскоклеточного рака легких, связанного с мутацией TP53, чаще встречались таксоны Acidovorax. Кроме того, было замечено, что представители родов Klebsiella, Comamonas, Acidovorax, Polaromonas и Rhodoferax чаще обнаруживаются в мелкоклеточной карциноме, но не в аденокарциноме. В последних исследованиях все больше внимания уделяется роли тканерезидентных полиморфных микробиомов в прогрессировании рака, что показало, что состав и численность внутриопухолевых бактерий или грибков коррелируют с типами или подтипами опухолей, статусом курения пациентов и ответом на иммунотерапию.
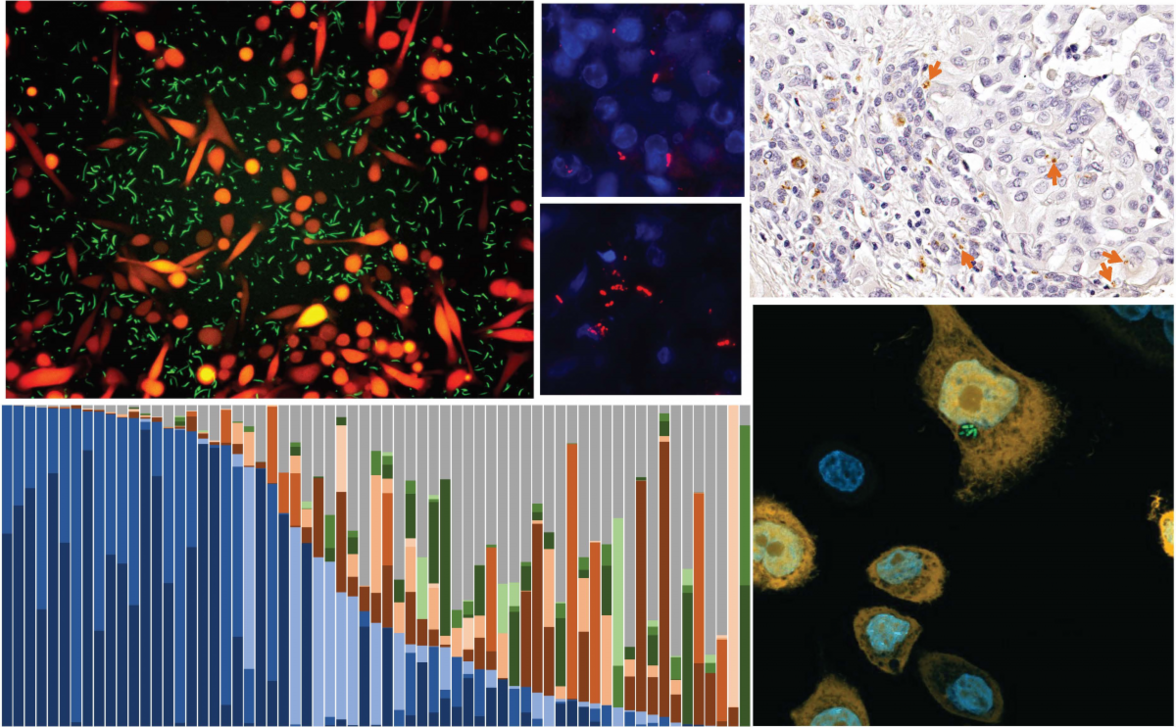
Современные исследования внутриопухолевых взаимодействий хозяина и микробиоты часто опираются на анализ объемных тканей, что не позволяет учесть неоднородность тканей при разрешении на уровне единичных клеток. Недавние достижения в области внутриклеточной локализации и корреляционной световой и электронной микроскопии позволили выявить локальные виды бактерий и грибков внутри опухолевых и иммунных клеток. Тем не менее, взаимодействие микробиоты и хозяина на уровне одной клетки во время прогрессии рака легких остается малоизученным.
В этом исследовании мы использовали анализ взаимодействия хозяина и микробиома на уровне одной клетки (SAHMI) для восстановления и ослабления микробных сигналов на основе данных секвенирования РНК на уровне отдельных клеток (scRNA-seq) в шести когортах больных раком легких. Мы стремились выяснить профили внутриопухолевого микробиома и его взаимодействие с раковыми клетками и различными типами/подтипами иммунных клеток, чтобы расширить субтипирование и улучшить стратегии персонализированного лечения рака.
Полученные нами данные свидетельствуют о том, что в первичных опухолевых тканях высока доля грибковых клеток, в то время как в метастатических тканях мозга преобладают бактериально-ассоциированные клетки. Наблюдается четкое распределение грибковых и бактериальных таксонов среди различных типов клеток. Примечательно, что присутствие специфических бактерий существенно влияет на транскриптомы резидентных клеток хозяина, включая Т-клетки и макрофаги, модулируя пути, связанные с процессингом рибосомальной РНК (рРНК), клеточными реакциями на стресс и стимулы, а также метаболизмом РНК и белков. Наконец, специфические клеточно-ассоциированные бактерии значительно коррелируют с клиническими характеристиками, такими как стадия рака легких и интенсивность курения.
Эти данные о взаимодействии микробиома и хозяина облегчают наше понимание развития и прогрессии рака легких, предлагая потенциальные микроэкологические и диагностические возможности.