Ученые изучают жизненный цикл вируса SARS-CoV-2 и его уловки.
У многих вирусов гликаны покрывают их внешние белки, маскируя их от иммунной системы человека, наподобие волка в овечьей шкуре. В прошлом году лаборатория Ромми Амаро, биофизика из Калифорнийского университете в Сан-Диего и ее коллеги создали самую подробную компьютерную визуализацию этой оболочки, основанную на структурных и генетических данных и созданную суперкомпьютером атом за атомом. 22 марта 2020 года она опубликовала эту визуализацию в Твиттере. В течение часа один из исследователей спросил в комментарии: что это за голая, непокрытая петля, торчащая из верхней части белка?
Амаро не имела ни малейшего представления. Но через десять минут структурный биолог Джейсон Маклеллан из Техасского университета в Остине сообщил: непокрытая петля была доменом связывания рецептора (RBD), одним из трех участков шипа, которые связываются с рецепторами на клетках человека.
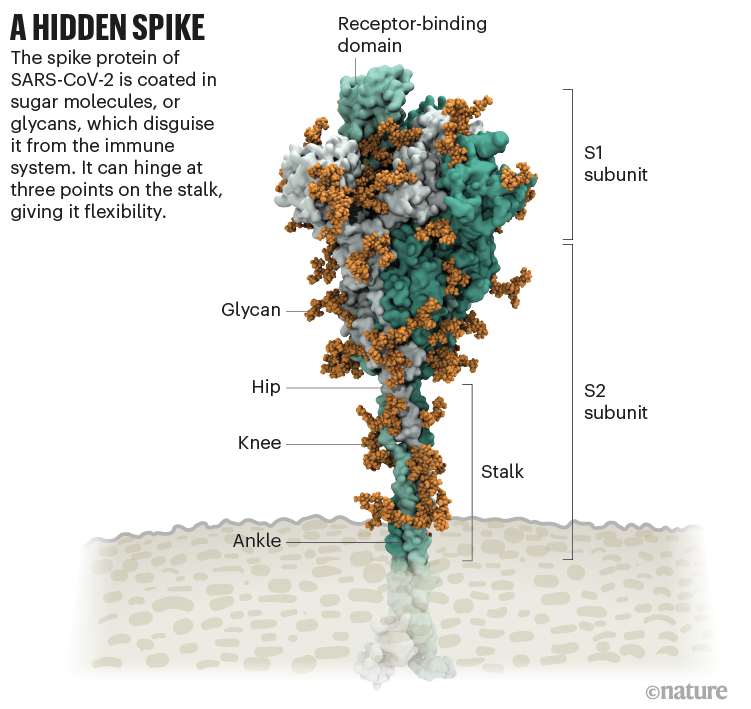
Источник: Структурное изображение от Лоренцо Казалино, Калифорнийский университет, Сан-Диего; Graphic: Nik Spencer/Nature
В модели Амаро, когда RBD поднимался над облаком гликанов, два гликана налетали на него и фиксировали его на месте, как подставку на велосипеде. Когда Амаро мутировала гликаны в компьютерной модели, RBD разрушался. Группа Маклеллана разработала способ провести тот же эксперимент в лаборатории, и к июню 2020 года сотрудники сообщили, что мутация двух гликанов снижает способность белка шипа связываться с клеточным рецептором человека - роль, которую ранее никто не признавал за коронавирусами, говорит Маклеллан. Возможно, что удаление этих двух сахаров может снизить инфекционность вируса, говорит Амаро, хотя у исследователей пока нет способа сделать это.
С момента начала пандемии COVID-19 ученые детально изучают, как SARS-CoV-2 инфицирует клетки. Разбирая процесс инфицирования, они надеются найти лучшие способы его прерывания с помощью усовершенствованных методов лечения и вакцин, а также узнать, почему новейшие штаммы, такие как вариант Дельта, являются более трансмиссивными.
В результате 19-месячной работы, подкрепленной десятилетиями предыдущих исследований коронавирусов, был получен подробный отчет о том, как SARS-CoV-2 вторгается в клетки человека. Ученые обнаружили ключевые адаптации, которые помогают вирусу с поразительной силой захватывать человеческие клетки, а затем прятаться внутри них. Позднее, покидая клетки, SARS-CoV-2 выполняет важнейший процесс подготовки своих частиц для инфицирования еще большего количества человеческих клеток. Это лишь некоторые из инструментов, которые позволили вирусу так быстро распространиться и унести миллионы жизней. "Именно поэтому его так трудно контролировать", - говорит Венди Барклай, вирусолог из Имперского колледжа Лондона.
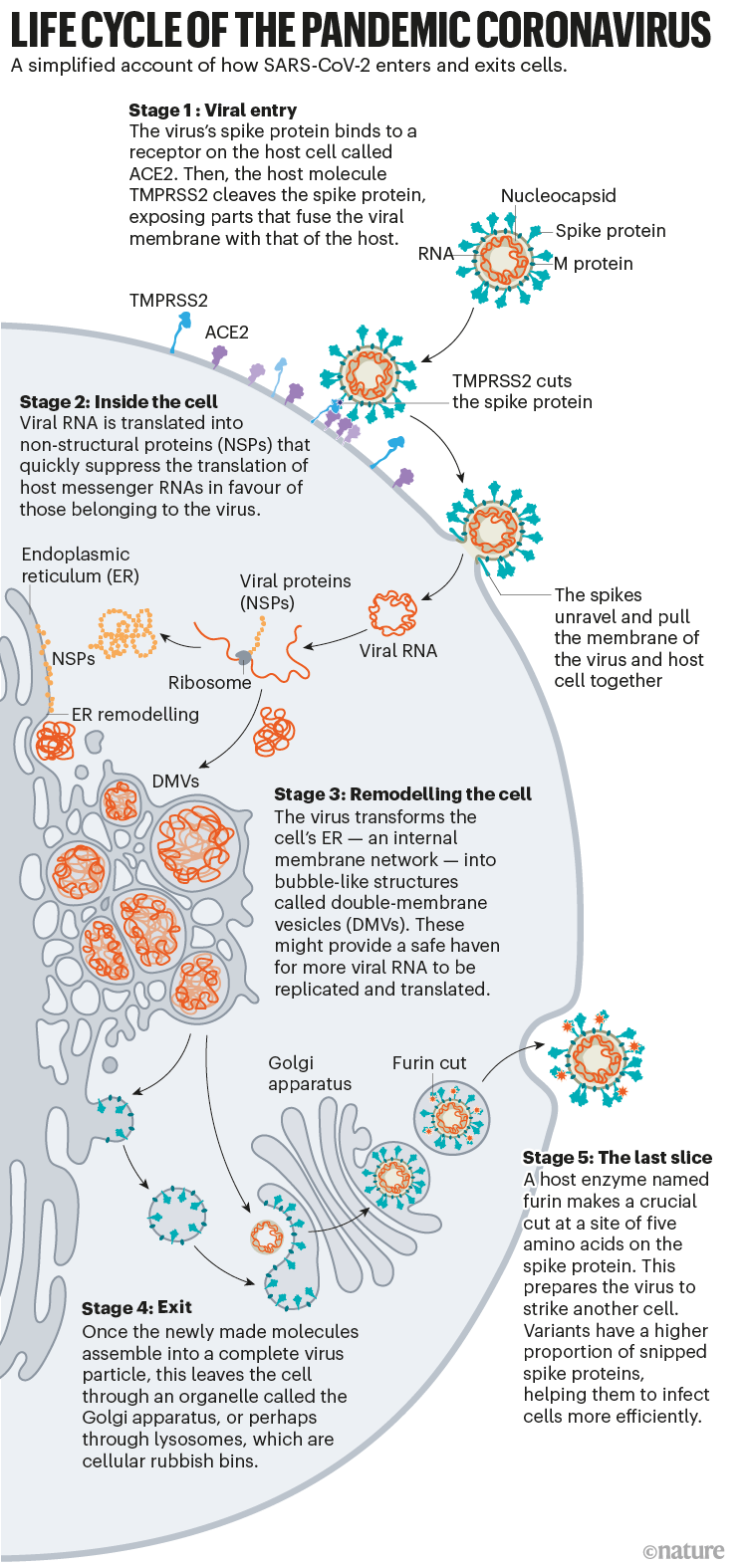
Источник: Hui (Ann) Liu, Univ. Utah; Графика: Nik Spencer/Nature
Все начинается с шипов. Каждый вирион SARS-CoV-2 имеет внешнюю поверхность, усеянную 24-40 беспорядочно расположенными белками-шипами, которые являются ключом к слиянию с клетками человека. У других типов вирусов, таких как грипп, внешние белки слияния относительно жесткие. Однако шипы SARS-CoV-2 отличаются невероятной гибкостью и соединяются с клеткой в трех точках, согласно работе, опубликованной в августе 2020 года биохимиком Мартином Беком из Института биофизики Макса Планка во Франкфурте (Германия) и его коллегами. Это позволяет шипам перемещаться, раскачиваться и вращаться, что может облегчить им сканирование клеточной поверхности и связывание нескольких шипов с клеткой человека. Подобных экспериментальных данных по другим коронавирусам нет, но поскольку последовательности белка шипа являются эволюционно консервативными, можно предположить, что этот признак является общим, говорит Бек.
В начале пандемии исследователи подтвердили, что RBD белков-шипов SARS-CoV-2 прикрепляются к белку - рецептору ACE2, который расположен снаружи большинства клеток слизистой оболочки носоглотки и легких человека. Этот рецептор также является точкой стыковки для SARS-CoV, вируса, вызывающего тяжелый острый респираторный синдром (SARS). Но по сравнению с SARS-CoV, SARS-CoV-2 связывается с ACE2 в 2-4 раза сильнее, поскольку некоторые изменения в RBD стабилизируют его связывающие точки. Вызывающие беспокойство варианты SARS-CoV-2, как правило, имеют мутации в субъединице S1 белка шипа, который содержит RBDs и отвечает за связывание с рецептором ACE2. (Вторая субъединица шипа, S2, способствует слиянию вируса с мембраной клетки-хозяина). Вариант Альфа, например, имеет десять изменений в последовательности белка шипа, которые приводят к тому, что RBD с большей вероятностью остаются в положении "вверху ". "Это помогает вирусу, облегчая его проникновение в клетки", - говорит Приямвада Ачарья, структурный биолог из Института вакцины человека Дьюка в Дареме, Северная Каролина, который изучает мутации шипа.
Вариант Дельта, который сейчас распространяется по всему миру, содержит множество мутаций в субъединице S1, включая три в RBD, которые, по-видимому, улучшают способность RBD связываться с ACE2 и обходить иммунную систему. Как только вирусные шипы связываются с ACE2, другие белки на поверхности клетки-хозяина запускают процесс, который приводит к слиянию вирусной и клеточной мембран. Вирус, вызывающий атипичную пневмонию, SARS-CoV, использует для проникновения в организм один из двух ферментов протеазы хозяина: TMPRSS2 (произносится как "tempress two") или катепсин L. TMPRSS2 - более быстрый путь проникновения, но SARS-CoV часто проникает в клетки через эндосому - пузырек, окруженный липидами, - который использует катепсин L. Однако когда вирионы проникают в клетки этим путем, противовирусные белки могут их задержать.
SARS-CoV-2 отличается от SARS-CoV тем, что он эффективно использует TMPRSS2, фермент, который в большом количестве содержится на внешней стороне респираторных клеток. Сначала TMPRSS2 разрезает участок на S2-субъединице шипа. Этот разрез обнажает участок гидрофобной аминокислоты, который быстро проникает в ближайшую мембрану - мембрану клетки-хозяина. Затем удлиненный шип застегивается как молния, заставляя вирусную и клеточную мембраны соединиться. Затем вирус выбрасывает свой геном прямо в клетку. Благодаря такому принципу вторжения, SARS-CoV-2 инфицирует быстрее, чем SARS-CoV, и не задерживается в эндосомах.
Быстрое проникновение вируса с помощью TMPRSS2 объясняет, почему малярийный препарат хлорохин не сработал в клинических испытаниях в качестве лечения COVID-19, несмотря на ранние многообещающие исследования. Оказалось, что в лабораторных экспериментах использовались клетки, которые зависят исключительно от катепсинов для эндосомального входа. "Когда вирус передается и реплицируется в дыхательных путях человека, он не использует эндосомы, поэтому хлорохин, который является препаратом, разрушающим эндосомы, не эффективен в реальной жизни", - говорит Барклай. Это открытие также указывает на ингибиторы протеаз как на перспективный терапевтический вариант, позволяющий предотвратить использование вирусом TMPRSS2, катепсина L или других протеаз для проникновения в клетки хозяина. Один из ингибиторов TMPRSS2, камостат мезилат, одобренный в Японии для лечения панкреатита, блокировал проникновение вируса в клетки легких, но препарат не улучшил результаты лечения пациентов в ходе первоначального клинического испытания.
"С моей точки зрения, мы должны иметь ингибиторы протеазы в качестве противовирусных препаратов широкого спектра действия для борьбы с новыми вспышками заболеваний и предотвращения будущих пандемий в их самом начале", - говорит Стефан Пёльман, директор отдела биологии инфекций в Немецком центре приматов в Геттингене, который возглавлял исследования по связыванию ACE2 и по механизму TMPRSS2.
Смертельная конкуренция
Следующие шаги инфекции более запутанны. Как только вы оказываетесь внутри клетки, появляется гораздо больше "черных ящиков", - говорит химик Джанет Иваса из Университета Юты в Солт-Лейк-Сити, которая разрабатывает анимацию жизненного цикла вируса. "Здесь больше неопределенности и конкурирующих гипотез".
После того как вирус впрыскивает свой РНК-геном в клетку, рибосомы в цитоплазме переводят два участка вирусной РНК в длинные нити аминокислот, которые затем расщепляются на 16 белков, включая многие, участвующие в синтезе РНК. Позже генерируется еще больше РНК, которые кодируют в общей сложности 26 известных вирусных белков, включая структурные, используемые для создания новых вирусных частиц, таких как шип, и другие вспомогательные белки. Таким образом, вирус начинает создавать копии своей собственной мессенджерной РНК. Но для перевода этих мРНК в белки ему необходим механизм клетки. Коронавирусы берут на себя управление этим механизмом различными способами. Вирусолог Ноам Штерн-Гиноссар и ее коллеги из Научного института Вейцмана в Реховоте, Израиль, изучили три механизма, с помощью которых SARS-CoV-2 подавляет трансляцию мРНК хозяина в пользу своей собственной. Ни один из них не является исключительным для этого вируса, но сочетание, скорость и величина эффектов представляются уникальными, говорит Штерн-Гиноссар.
Во-первых, вирус устраняет конкурентов: вирусный белок Nsp1, один из первых белков, транслируемых при появлении вируса, привлекает белки хозяина для систематического измельчения всех клеточных мРНК, не имеющих вирусной метки. Когда сотрудники Штерн-Гиноссар поместили такую же метку на конец мРНК хозяина, мРНК не была разрушена.
Во-вторых, инфекция снижает общую трансляцию белков в клетке на 70%. Nsp1 снова является главным виновником, на этот раз физически блокируя входной канал рибосом, чтобы мРНК не могла попасть внутрь. Оставшаяся небольшая способность к трансляции предназначена только для работы с вирусными РНК.
Наконец, вирус отключает систему сигнализации клетки. Это происходит множеством способов, но группа Штерн-Гиноссар выявила один четкий механизм для SARS-CoV-2: вирус не дает клеточной мРНК выйти из ядра, выключая инструкции для белков, предназначенных для предупреждения иммунной системы об инфекции. Вторая исследовательская группа подтвердила этот вывод и снова указала на Nsp1: этот белок, похоже, закупоривает выходные каналы в ядре, чтобы ничто не могло выбраться наружу.
Поскольку транскрипты генов не могут выйти из ядра, инфицированные клетки не выделяют достаточно интерферонов - сигнальных белков, которые предупреждают иммунную систему о присутствии вируса. SARS-Cov-2 особенно эффективно отключает эту систему сигнализации: по сравнению с другими респираторными вирусами, включая SARS-CoV и респираторно-синцитиальный вирус, инфекция SARS-CoV-2 индуцирует значительно более низкий уровень интерферонов. А в июне этого года исследователи сообщили о мутациях в варианте Альфа, которые, по-видимому, позволяют ему еще более эффективно подавлять выработку интерферонов.
"Очевидно, что SARS-CoV-2 - очень быстрый вирус, обладающий уникальной способностью мешать нашей иммунной системе распознавать и бороться с инфекцией на первых стадиях, - говорит Штерн-Гиноссар. К тому времени, когда иммунная система осознает наличие вируса, его становится так много, что белки иммунного ответа иногда проникают в кровь быстрее, чем обычно, что может привести к повреждениям". В начале пандемии врачи заметили, что некоторые люди с COVID-19, страдают от чрезмерно активного иммунного ответа на SARS-CoV-2. Некоторые проверенные методы лечения работают благодаря ослаблению этого иммунного ответа.
Ремонтная станция
После того как вирус захватил трансляцию хозяина, он приступает к домашнему ремонту, переделывая внутреннюю и внешнюю поверхность клетки в соответствии со своими потребностями. Сначала некоторые из вновь созданных вирусных белков-шипов перемещаются на поверхность клетки и высовываются из клеточной мембраны хозяина. Там они активируют кальций-ионный канал хозяина, который выбрасывает жировое покрытие на внешнюю сторону клетки - такое же покрытие имеется на клетках, которые естественным образом сливаются вместе, например, мышечных клетках. В этот момент инфицированная клетка сливается с соседними клетками, экспрессирующими ACE2, превращаясь в массивные одиночные респираторные клетки, содержащие до 20 ядер.
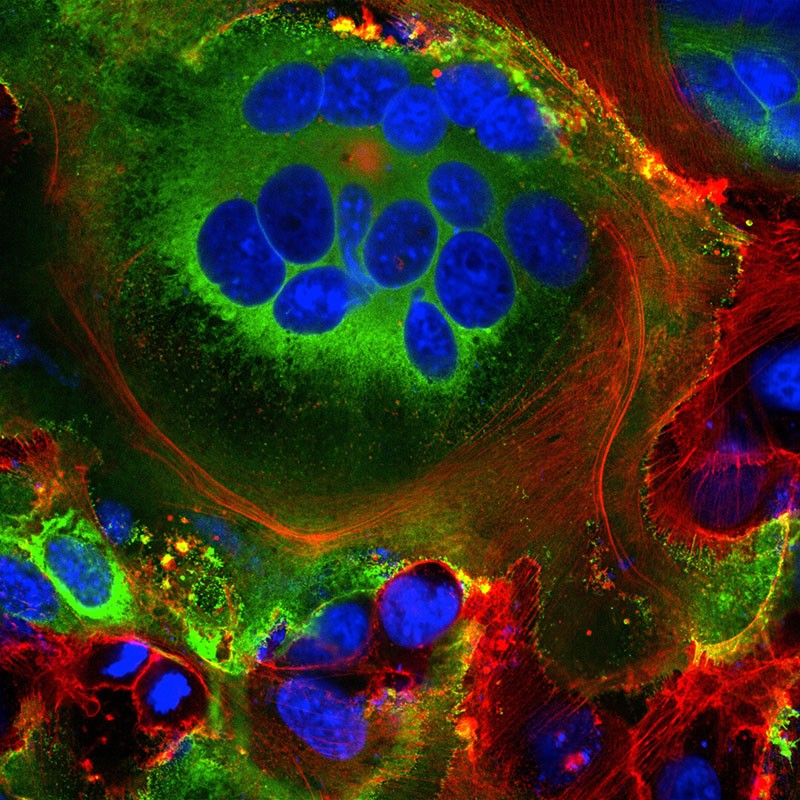
Слившиеся клеточные структуры, наблюдаемые в клетках, экспрессирующих белок шипа SARS-CoV-2 (зеленый). Ядра выделены синим цветом, а клеточный остов - красным.Credit: Mauro Giacca
Эти слившиеся структуры, называемые синцитиями, вызываются вирусными инфекциями, такими как ВИЧ и вирус простого герпеса, но не вирусом SARS, говорит молекулярный биолог Мауро Джакка из Королевского колледжа Лондона, возглавлявший группу, опубликовавшую результаты исследования в апреле. Он предполагает, что образование синцития позволяет инфицированным клеткам процветать в течение длительного времени, производя все больше и больше вирионов. "Это не вирус, который бьет и убегает", - говорит он. "Он продолжает существовать". Вторая группа под руководством исследователя Цянь Суня из Китайской академии медицинских наук в Пекине обнаружила, что некоторые инфицированные COVID-19 клетки даже образуют синцитий с лимфоцитами. Это известный механизм уклонения от иммунитета опухолевых клеток, но не вирусов. Это позволяет предположить, что инфицированные клетки избегают иммунного обнаружения, просто захватывая и объединяясь с близлежащими иммунными разведчиками.
Внутри клетки происходит еще больше изменений. Как и другие коронавирусы, SARS-CoV-2 превращает длинный, тонкий эндоплазматический ретикулум (ЭР), сеть плоских мембран, участвующих в синтезе и транспортировке белка, в двух-мембранные сферы, как если бы ЭР надувал пузырьки. Эти двухмембранные везикулы (ДМВ) могут служить безопасным местом для репликации и трансляции вирусной РНК, защищая ее от датчиков врожденного иммунитета в клетке, но эта гипотеза еще изучается. Белки, участвующие в создании ДМВ, могут быть хорошими мишенями для лекарственных препаратов, поскольку они, по-видимому, необходимы для вирусной репликации. Например, белок хозяина, TMEM41B, необходим для мобилизации холестерина и других липидов для расширения мембран ЭР, чтобы все части вируса поместились внутри. "Если убрать TMEM41B, это сильно повлияет на инфекцию", - говорит Винет Меначери, исследователь коронавирусов из Медицинского отделения Техасского университета в Галвестоне, принимавший участие в исследовании. Трансмембранный белок коронавируса Nsp3 также может стать мишенью: он создает в стенках ДМВ поры для перемещения только что созданной вирусной РНК.
Большинство вирусов, имеющих внешнюю оболочку, называемую конвертом, формируют ее путем сборки непосредственно на краю клетки, кооптируя часть плазматической мембраны клетки по пути наружу. Но недавно созданные белки коронавируса идут другим путем.
В последние годы появились доказательства того, что коронавирусы выводятся из клетки через комплекс Гольджи - органеллу, которая работает как почтовое отделение, упаковывая молекулы в мембраны и отправляя их в другие части клетки. Там вирус формирует липидную оболочку из мембраны комплекса Гольджи; затем вновь образованные вирионы переносятся внутри везикул Гольджи к поверхности клетки, где они выплевываются из клетки, говорит вирусолог и клеточный биолог Кэролин Мачамер из Университета Джона Хопкинса в Балтиморе, штат Мэриленд, которая изучает коронавирусы уже 30 лет.
Но в декабре клеточный биолог Нихал Алтан-Боннет из Национального института сердца, легких и крови США в Бетесде, штат Мэриленд, и ее коллеги сообщили, что они обнаружили коронавирусы, покидающие клетку через лизосомы - клеточные мусорные контейнеры, наполненные ферментами, которые расщепляют части клетки. Блокирование секреторного пути, основанного на системе Гольджи, не повлияло на количество выделяемого инфекционного вируса, говорит Алтан-Боннет. Полученные ее группой данные позволяют предположить, что вирусные белки формируют оболочку, отпочковываясь в ЭР, а затем захватывают лизосомы, чтобы выйти из клетки. В настоящее время исследователи тестируют ингибиторы, блокирующие процесс выхода из лизосом, в качестве потенциальных противовирусных препаратов.
Выход из клетки через Гольджи или лизосомы происходит медленно и неэффективно по сравнению с выходом из плазматической мембраны, поэтому ученые не знают, почему SARS-CoV-2 делает это. Мачамер подозревает, что липидный состав оболочки, полученной из Гольджи или лизосом, каким-то образом более благоприятен для вируса, чем оболочка из плазматической мембраны. "Если бы мы поняли эту часть немного лучше, открылись бы большие возможности для новых противовирусных терапий", - говорит она.
Последний фрагмент
На пути из клетки еще одно событие превращает этот вирус в инфекционный джаггернаут: быстрое отщепление участка из пяти аминокислот готовит вирус к нанесению удара по следующей цели.
Там, где у других коронавирусов на стыке субъединиц S1 и S2 шипа находится одна аминокислота аргинин, у SARS-CoV-2 есть линия из пяти аминокислот: пролин, аргинин, аргинин, аланин и аргинин. "Поскольку этот участок был необычным, мы сосредоточились на нем, и оказалось, что да, этот участок необходим для вторжения в клетки легких", - говорит Пёльман. В мае 2020 года он и его коллеги сообщили, что белок клетки-хозяина под названием фурин распознает и разрезает эту последовательность аминокислот - и этот разрез "необходим" для эффективного проникновения вируса в клетки легких человека.
Это не первый случай, когда исследователи выявили участок расщепления фурина в вирусе: он есть и у высокопатогенных вирусов птичьего гриппа, говорит Барклай. Когда коллега прислал Барклаю штамм SARS-CoV-2 в культуре, который спонтанно потерял сайт расщепления фурина, ее группа обнаружила, что хорьки, инфицированные этим штаммом, выделяли вирусные частицы в меньшем количестве, чем хорьки, инфицированные пандемическим штаммом, и не передавали инфекцию соседним животным. В то же время, когда группа Барклай сообщила о своих результатах в препринте от сентября 2020 года, исследование, проведенное в Нидерландах, также показало, что коронавирус с неповрежденным сайтом расщепления фурина проникает в клетки дыхательных путей человека быстрее, чем без него.
Предполагается, что фурин вырезает этот участок в какой-то момент во время сборки вириона или непосредственно перед выходом. Это обстоятельство может объяснить, почему вирус выходит через Гольджи или лизосомы, говорит Том Галлахер, вирусолог из Университета Лойолы в Чикаго, штат Иллинойс. "Вирус после сборки перемещается в органеллу, где он может принять ванну в присутствии протеазы фурина". Разрывая связь между субъединицами S1 и S2, фурин разрыхляет белки шипов вириона так, что во время входа в клетку они реагируют на второй разрез TMPRSS2, который обнажает гидрофобный участок, быстро укрывающийся в мембране клетки-хозяина, говорит Галлахер. Если шипы не были предварительно обрезаны фурином - а это происходит не всегда - они обходят TMPRSS2 и попадают в клетку через более медленный эндосомальный путь, если вообще попадают.
Два варианта коронавируса, Альфа и Дельта, имеют измененные участки расщепления фурина. В варианте Альфа начальная аминокислота пролин заменена на гистидин (P681H), а в варианте Дельта - на аргинин (P681R). Оба изменения делают последовательность менее кислотной, и чем проще последовательность аминокислот, тем эффективнее фурин распознает и разрезает ее, говорит Барклай. "Мы можем предположить, что таким образом вирус становится еще лучше в передаче инфекции".
Больше разрезов фурина означает больше белков-шипов, готовых проникнуть в клетки человека. В SARS-CoV менее 10% белков спайков являются праймированными, говорит Меначери, чья лабораторная группа провела количественную оценку праймированных белков спайков, но еще не опубликовала эту работу.
В случае SARS-CoV-2 этот процент увеличивается до 50%. В варианте Альфа - более 50%. В высокотрансмиссивном варианте Дельта, как установила группа, более 75% шипов готовы к инфицированию человеческой клетки.
Известные неизвестные
Научное сообщество все еще лишь нащупывает основу для понимания SARS-CoV-2. По словам Маклеллана, основные неизвестные вопросы включают: количество рецепторов ACE2, необходимых для связывания с каждым белком шипа; когда именно сайт S2 расщепляется TMPRSS2; количество шипов, необходимых для слияния мембраны вируса с клеткой - и это только на начальном этапе. В апреле 2020 года группа специалистов из Калифорнийского университета в Сан-Франциско выявила не менее 332 видов взаимодействия между SARS-CoV-2 и человеческими белками.
Нелегко угнаться за быстро мутирующим вирусом. По мнению экспертов, большинство мутаций пока связаны с тем, насколько эффективно распространяется вирус, а не с тем, насколько сильно он повреждает хозяина. В этом месяце в одном из исследований сообщалось, что вариант Дельта развивается быстрее и на более высоких уровнях внутри легких и носоглотки людей, чем более ранние версии вируса. Но пока не ясно, каким образом мутации Дельты усилили этот вариант, говорит Штерн-Гиноссар. "Это то, что пытаются выяснить многие лаборатории".

