Первое в истории моделирование "атом за атомом" на суперкомпьютере показывает, как антибиотики убивают бактерии, и иллюстрирует другие процессы молекулярного механизма в живых клетках.
Эта работа открывает новые пути для совершенствования антибиотиков, создания новых препаратов для борьбы с лекарственно-устойчивыми бактериями и разработки вакцин против вирусов, таких как SARS-CoV-2.
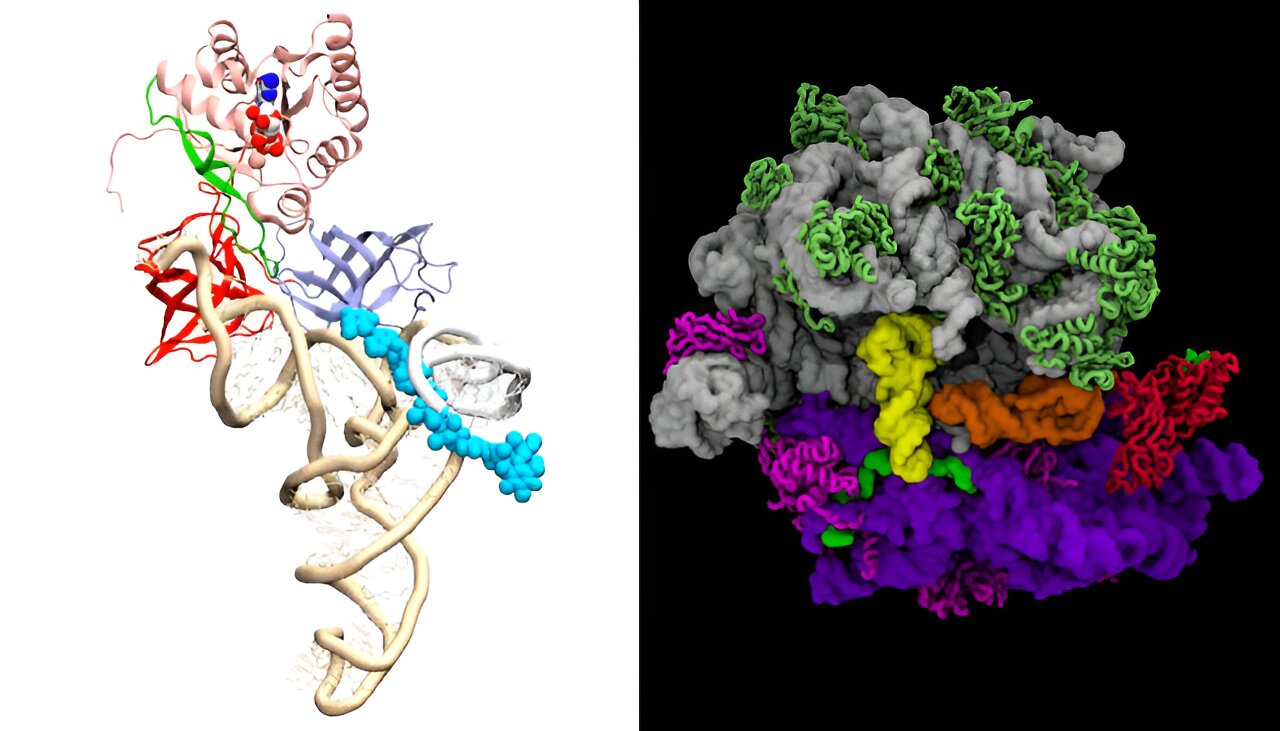
"Рибосома - это центральная молекулярная машина, обрабатывающая информацию во всех формах жизни. Она должна расшифровывать информацию о принятии правильных и отклонении неправильных аминокислот для построения белков в клетке", - объясняет Карисса Санбонмацу, структурный биолог из Лос-Аламосской национальной лаборатории, который является соавтором новой статьи о прорывном методе моделирования, опубликованной в журнале Nature Communications.
"Используя суперкомпьютеры, мы смогли воспроизвести этот процесс атом за атомом и показать, как антибиотики влияют на этот процесс", - рассказывает Санбонмацу. "Подобные исследования крайне важны для борьбы с возникающим кризисом антибиотикорезистентных бактерий. Для борьбы с резистентностью к противомикробным препаратам мы должны понять, как работают обычные антибиотики, если хотим разработать новые". Лаборатория Санбонмацу координировала исследование рибосом, которое также имеет значение для лечения рака и понимания происхождения жизни. Исследование тесно объединило эксперименты с одиночными молекулами и моделирование на суперкомпьютере.
Мессенджерная РНК, или мРНК, несет в себе коды, содержащие информацию для создания определенных белков в клетке. Рибосома декодирует эту генетическую информацию, считывая коды с мРНК, протягивая мРНК через рибосому подобно тому, как кассетный магнитофон "считывает" информацию с ленты. Рибосома просматривает коды в молекулярно-информационной базе данных, которая представляет собой набор молекул, называемых трансферными (транспортными) РНК, или тРНК, для выбора определенных аминокислот и производит белки на основе этих закодированных инструкций.
Для каждой кодовой единицы в мРНК рибосома перебирает аминокислоты и выбирает правильную аминокислоту, соответствующую этой кодовой единице, отбрасывая при этом неправильные аминокислоты. Молекулы тРНК доставляют основные строительные блоки белков к рибосомам. Затем рибосома собирает белок, добавляя к нему нужную аминокислоту. По словам Санбонмацу, многие антибиотики действуют так: они засоряют этот молекулярный механизм в рибосомах бактерий. Препараты либо останавливают этот механизм, либо вызывают ошибки в обработке информации, в результате чего белки формируются неправильно, что приводит к гибели бактерий.
В отличие от этого, вакцины на основе мРНК воздействуют на рибосомы человека, убеждая их производить белки вируса, что помогает вакцинировать организм. Более глубокое понимание того, как рибосома считывает мРНК, достигнутое с помощью суперкомпьютеров, поможет исследователям разработать более эффективные антибиотики и вакцины. "Около 50% всех антибиотиков ингибируют функцию рибосом, поэтому мы знаем, что это эффективная стратегия для антибиотиков", - пояснил Санбонмацу. "Для разработки новых антибиотиков нам необходимо понять, как работают рибосомы на атомарном уровне".
Для этого исследовательская группа смоделировала молекулярную динамику взаимодействия между рибосомами и тРНК. "Наше моделирование показало, что неправильные молекулы тРНК приобретают неправильную геометрию при взаимодействии с рибосомами", - сообщил Санбонмацу. "Введя в симуляцию антибиотики гентамицин, неомицин, эвернимицин и гигромицин, мы продемонстрировали, что антибиотики влияют на геометрию тРНК, заставляя рибосому включать неправильную тРНК или не включать ее вовсе". Это убивает бактерии.
"Рибосомы - массивные биомолекулы, и достижение необходимых временных масштабов для наблюдения за динамикой рибосом требует огромных вычислительных ресурсов, таких как те, что доступны на высокопроизводительном вычислительном кластере в Лос-Аламосе", - отметил Санбонмацу.