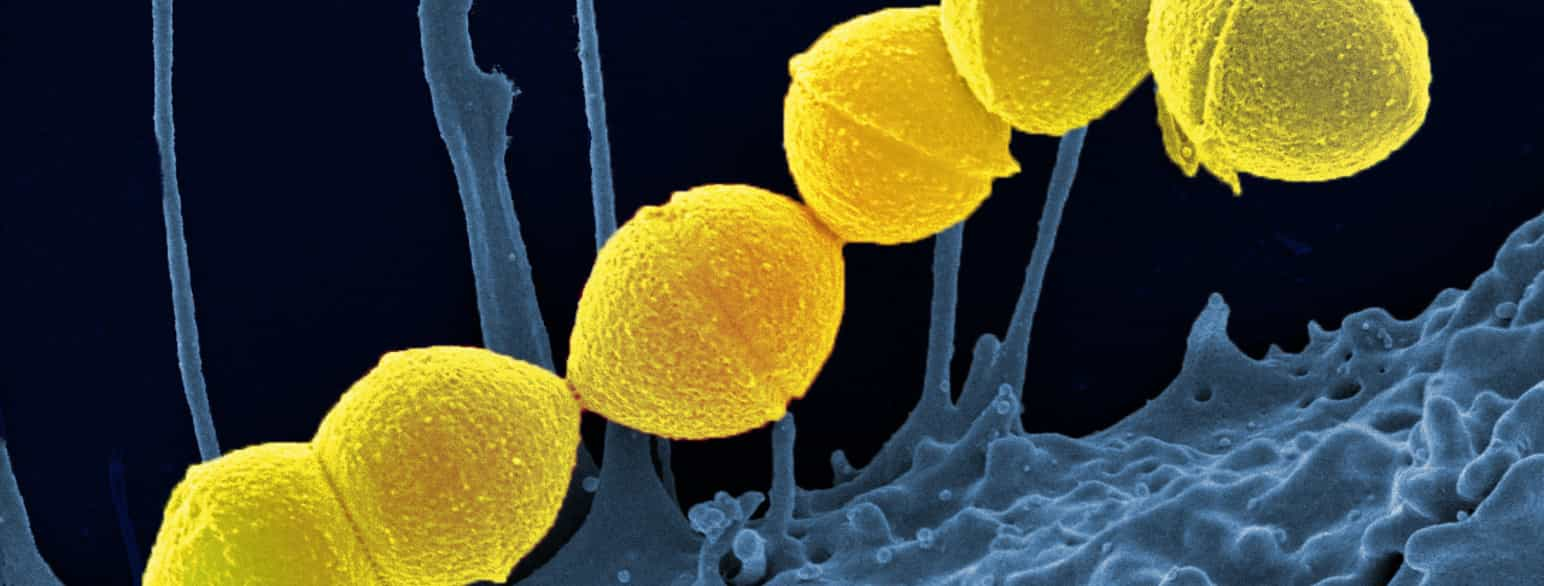
Австралийские исследователи выяснили, как Streptococcus pneumoniae (пневмококк) получает важнейшее питательное вещество, марганец, из нашего организма, что может привести к созданию более эффективных методов лечения этого опасного для жизни, резистентного к антибиотикам патогена.
Пневмококк - один из самых смертоносных организмов в мире, ежегодно вызывающий более миллиона смертей и являющийся ведущей инфекционной причиной смертности среди детей младше пяти лет. Он является основной причиной бактериальной пневмонии, а также одной из основных причин менингита, сепсиса и инфекций внутреннего уха (средний отит).
Опубликовав в журнале Science Advances результаты десятилетних детальных исследований, ученые из Института инфекции и иммунитета Питера Доэрти (Институт Доэрти) и Института молекулярной науки и биотехнологии Bio21 вместе с коллегами из Австралийского национального университета и Университета Киото (Япония) определили структуру уникального "шлюза", который пневмококк использует для кражи марганца из организма.
Все организмы, включая патогенные, нуждаются в витаминах и минералах для выживания. Хотя исследователи знали, что марганец имеет решающее значение для выживания пневмококка, как он забирает марганец из организма, было непонятно. Меган Махер, руководитель лаборатории Bio21, говорит в интервью Science Daily, что они заметили, что бактерия забирает питательные вещества регулируемым образом. "В конце концов мы обнаружили, что это связано с уникальным шлюзом в мембране бактерии, который открывается и закрывается, чтобы специально пропускать марганец", - рассказывает Махер. "Это совершенно новая структура, которая никогда не встречалась у подобных патогенов".
Профессор Мельбурнского университета Кристофер Макдевитт, руководитель лаборатории в Институте Доэрти, отметил, что результаты исследования меняют наши представления о выживаемости патогена. "Ранее считалось, что эти шлюзы действуют как каналы с тефлоновым покрытием в том смысле, что все просто проходит через них", - объяснил профессор Макдевитт.
"Теперь мы понимаем, что они избирательно забирают марганец. Любое нарушение этого шлюза лишает патоген марганца, что не позволяет ему вызывать заболевание".
Это может стать ключом к лучшим и альтернативным методам лечения пневмококка. Хотя пневмококковая вакцина существует, она обеспечивает лишь ограниченную защиту от циркулирующих штаммов, а уровень резистентности к антибиотикам быстро растет. "Это действительно привлекательная терапевтическая мишень, поскольку она находится на поверхности бактерии, а наш организм не использует этот тип шлюза", - сказал Макдевитт. "В то время, когда мы наблюдаем рост резистентности к антибиотикам первой и последней линии и появление "супербактерий", важно, что бы мы смогли разработать новые стратегии борьбы с этим смертельно опасным микроорганизмом".
Stephanie L. Neville et al. Структурная основа бактериального импорта марганца (аннотация).
Ионы металлов необходимы для всех форм жизни. У прокариот АТФ-связывающие кассеты (АВС) пермеазы служат основным путем импорта многих микроэлементов, включая переходный металл первого ряда - марганец. Однако структурные особенности ABC-пермеаз, транспортирующих ионизированные металлы, до сих пор не определены.
В настоящем исследовании мы представляем кристаллическую структуру транспортера марганца PsaBC из Streptococcus pneumoniae в открытой внутрь конформации. Этот транспортер II типа имеет плотно закрытый трансмембранный канал благодаря остаткам "внеклеточного стробирования", которые препятствуют проницаемости воды или рефлюксу ионов. Ниже этих остатков канал содержит до сих пор не описанный сайт координации металла, который необходим для транслокации марганца. Мутагенез внеклеточных ворот нарушает поглощение марганца, а мутагенез координационного сайта отменяет импорт. Эти структурные особенности высоко консервативны в металлоспецифических ABC-транспортерах и представлены во всех царствах жизни.
В совокупности наши результаты определяют структуру PsaBC и раскрывают особенности, необходимые для транспорта двухвалентных катионов.