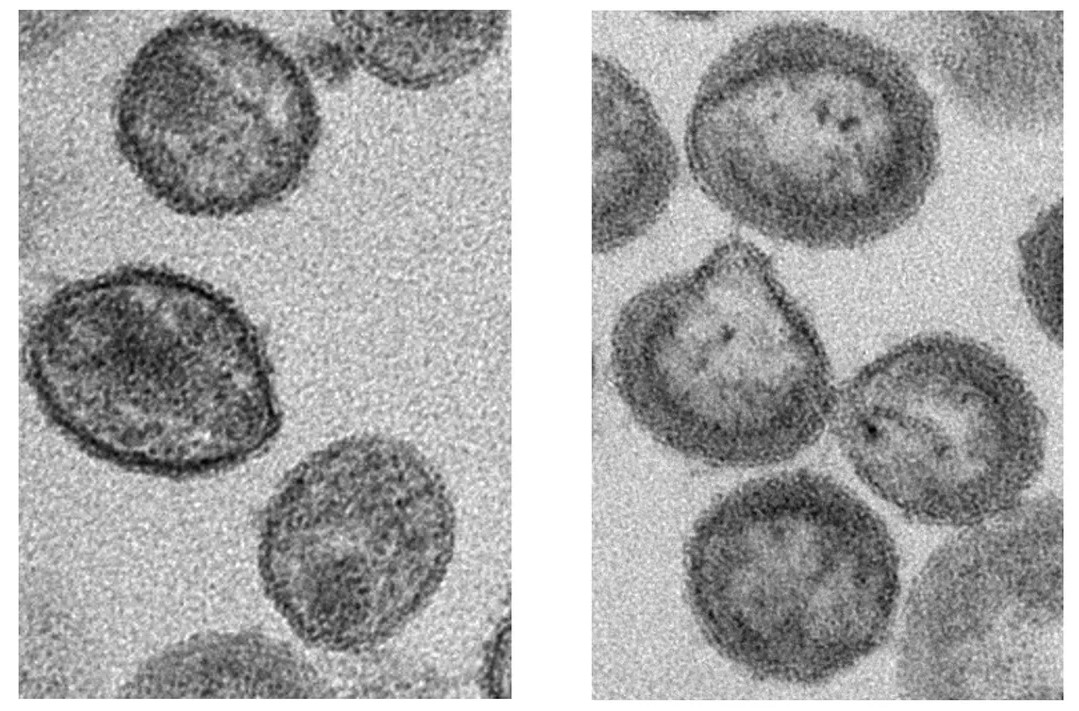
Липид-модифицирующий фермент хозяина играет ключевую роль в формировании оболочки ВИЧ, созревании вируса и его инфекционности.
С момента открытия ВИЧ в 1980-х годах ученые прошли долгий путь в понимании различных этапов, необходимых для его сборки и созревания. Исследователи знали, что ВИЧ обволакивает свои основные вирусные компоненты липидной оболочкой, образованной из плазматической мембраны хозяина. Однако они не знали, как ВИЧ контролирует перестройку клеточной мембраны при выходе из клеток и какую роль липидная оболочка играет в репликации ВИЧ.
В работе, опубликованной в Proceedings of the National Academy of Sciences (PNAS), исследователи описали внутриклеточный фермент нейтральную сфингомиелиназу-2 (nSMase2) как ключевого игрока в репликации ВИЧ. Блокируя nSMase2, ученые нарушили процесс формирования вирусных частиц ВИЧ типа 1 (ВИЧ-1) и предотвратили инфицирование вирусом. Ингибирование nSMase2 также снижало уровень вируса в плазме крови в мышиных моделях и предотвращало или задерживало развитие вирусного рецидива. Эти результаты позволяют раскрыть новый механизм, используемый ВИЧ, и могут указать на новую мишень для антиретровирусной терапии.
"Вирусы в целом, поскольку их способность к кодированию весьма ограничена, вынуждены в значительной степени полагаться на механизмы клеток хозяина при репликации", - пояснил Эрик Фрид, клеточный и молекулярный биолог из Национального института рака США и соавтор статьи. "Данное исследование показывает, что этот фермент [nSMase2] является таким ферментом, который вирус, очевидно, использует в своей стратегии репликации".
Предыдущие исследования показали, что ВИЧ-инфекция повышает уровень церамидов - семейства липидов, содержащихся в высокой концентрации в клеточной мембране, и что у людей, инфицированных ВИЧ, наблюдается повышенный уровень этих липидов в тканях мозга и спинномозговой жидкости. В ходе исследования ученые сосредоточились на nSMase2, поскольку этот фермент производит церамиды из липида сфингомиелина. "Этот фермент также находится во внутреннем листке плазматической мембраны, что позволяет ему контролировать клеточные сигналы, а также аспекты вирусной репликации", - уточнил Фрид.
Чтобы проверить, является ли nSMase2 необходимым для вирусной репликации, авторы ингибировали фермент с помощью противовирусного соединения [фенил(R)-(1-(3-(3,4-диметоксифенил)-2, 6-диметилимидазо[1,2-b]пиридазин-8-ил) пирролидин-3-ил)-карбамат] (PDDC), которое они синтезировали в лаборатории, или путем подавления экспрессии nSMase2 с помощью РНК-интерференции. В культурах человеческих клеток вмешательство в активность фермента приводило к образованию вирусных частиц неправильной формы с пониженным содержанием церамида, которые не созревали и не становились инфекционными.
"Эти результаты показывают - возможно, более убедительно, чем большинство, если не все предыдущие работы, - что липидный состав оболочки ВИЧ имеет решающее значение для создания инфекционного вируса", - утверждает Пол Бениаш, вирусолог из Рокфеллеровского университета, не принимавший участия в исследовании.
Далее исследователи оценили эффект ингибирования активности nSMase2 у мышей. Они заразили мышей ВИЧ-1, затем половину животных лечили комбинацией антиретровирусных препаратов, а другую половину - ингибитором nSMase2. Наблюдая за вирусной нагрузкой в плазме крови, они обнаружили, что оба препарата эффективно снижают уровень ВИЧ. Однако после прекращения лечения у мышей, получавших антиретровирусные препараты, наблюдался вирусный рецидив, в то время как у мышей, получавших ингибитор nSMase2, вирусного рецидива не наблюдалось или он был замедлен.
Затем авторы проверили влияние ингибитора nSMase2 на жизнеспособность клеток, подвергнув человеческие клетки воздействию различных концентраций PDDC. Блокирование активности nSMase2 вызвало апоптотический фенотип в клетках, в которых активно реплицировался ВИЧ-1. По словам Фрида, эти результаты отличаются от известных эффектов всех доступных в настоящее время антиретровирусных препаратов, которые подавляют репликацию ВИЧ, но не способствуют апоптозу в инфицированных клетках, поэтому, как только люди прекращают прием препаратов, вирусная репликация начинается снова.
Несмотря на многообещающие результаты, остаются открытыми вопросы о том, можно ли использовать ингибитор nSMase2 в качестве средства против ВИЧ, отметил Беньяш. "Смогут ли животные выжить в течение длительного времени при ингибировании этого фермента? Это ключевой вопрос в плане перехода от этой очень элегантной лабораторной работы к полезному лекарству", - добавил он.
Фрида и коллег также интересовало, нуждаются ли другие ретровирусы в nSMase2 в процессе созревания. Результаты, описанные в сопутствующей статье в PNAS, показали, что более отдаленные родственники, лентивирусы, не обитающие в приматах, не требуют nSMase2 для формирования зрелых и инфекционных вирусных частиц. По словам Фрида, понимание того, почему вирусы приматов различаются по своим требованиям к формированию зрелых вирусных частиц, является интересным вопросом, который он планирует изучить. Фрид, который изучает сборку ВИЧ уже более 20 лет, считает, что результаты обоих исследований помогают прояснить критическую роль липидного состава оболочки вируса в сборке ВИЧ и, возможно, в его созревании. "Это действительно начало пути к изучению nSMase2 и, возможно, других ферментов, модифицирующих липиды, в качестве потенциальных терапевтических мишеней", - сказал он.