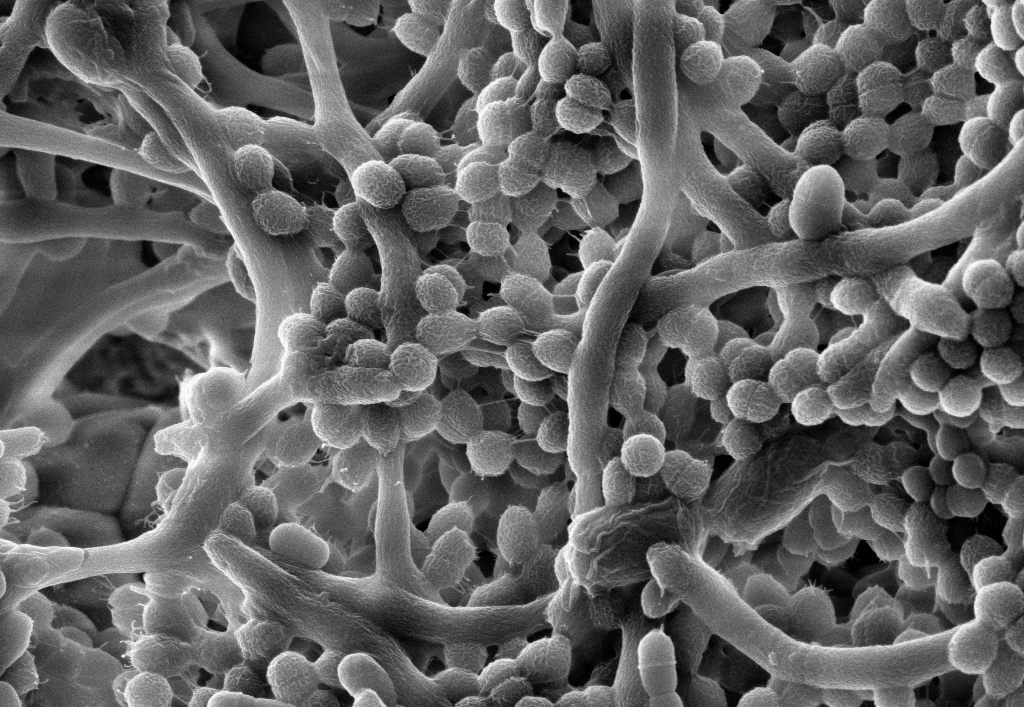
Биопленки давно известны в природе, их можно обнаружить на самых разных поверхностях, включая камни в ручьях (слизь), зубы млекопитающих, корни растений и даже водопроводные трубы.
Биопленки могут быть наиболее адаптируемой особенностью микроорганизмов в природе. Однако, когда соответствующие микроорганизмы являются патогенными, эта способность объединяться в биопленки становится важным фактором вирулентности. Фактически, подавляющее большинство человеческих инфекций опосредовано биопленками. Биопленочные инфекции часто связаны с медицинскими устройствами (протезы коленного сустава, катетеры, имплантаты, контактные линзы, протезы клапанов и суставов, винты и штифты) или с тканями (например, хронические раны, "стафилококковые" инфекции кожи, эндокардит, хронический средний отит, муковисцидоз легких). Более того, биопленки могут влиять на эффективность антимикробных препаратов, а также на иммунный ответ, способствуя развитию резистентности к антимикробным препаратам и позволяя развиваться персистирующим/хроническим инфекциям.
Поскольку биопленки часто являются полимикробными, их лечение может стать еще более трудным, если не невозможным. Одним словом, такое взаимодействие микробов (особенно бактерий) с поверхностями имеет далеко идущие и критические последствия в таких областях, как динамика распространения инфекций. Для того чтобы бороться с настоящим коварством этих микробных противников, работники здравоохранения и других смежных отраслей должны лучше понять строение и механизмы действия биопленок.
Биопленка - это трехмерная структура, которая действует как передовая линия борьбы микроорганизмов. Биопленки могут начать формироваться, когда группа микроорганизмов чувствует определенную поверхность и прилипает к ней. Последующая колонизация и производство внеклеточного полисахаридного матрикса (EPS) укрепляют структуру. Вещество матрикса EPS является адгезивным, в результате чего бактерии оказываются в настоящих каналах - структурированных "умных сообществах" - подобно бойцам в окопах. Канальная структура защищает внутреннюю поверхность бактерий от внешней среды; это эффективно создает скрытый маршрут для доставки питательных веществ и отвода отработанных побочных продуктов и обеспечивает постоянную колонизацию и созревание внедренных бактерий. Когда микроорганизмы созревают, они могут отделяться и перемещаться из созревшей биопленки, чтобы присоединиться к другому сообществу биопленок или основать новое.
Роль биопленок в развитии антимикробной резистентности (AMR) очень сложна и может в значительной степени определять ее. Бактерии, живущие в биопленке, могут демонстрировать 10-1000-кратное увеличение антибиотикорезистентности по сравнению с аналогичными бактериями, живущими в планктонном состоянии. Например, в исследовании резистентности к антибиотикам Staphylococcus epidermidis в биопленках, 100% изолятов были чувствительны к антибиотику ванкомицину, когда тестировались в планктонном состоянии. Тем не менее, почти 75% из них были полностью резистентны к тому же антибиотику при тестировании биопленки. Аналогичная картина наблюдалась и для таких организмов, как Klebsiella pneumoniae, которые оказываются чувствительными при тестировании из водного раствора, но становятся очень резистентными к определенным антибиотикам при тестировании биопленки.
В бактериях распространенные механизмы резистентности к антибиотикам включают точечные мутации, ферменты и эффлюксные насосы. Однако эти механизмы сами по себе вряд ли ответственны за резистентность, наблюдаемую у организмов в биопленке. Различные компоненты работают в биопленке в тандеме, чтобы снизить или полностью предотвратить эффективность антибиотиков и еще больше повысить резистентность. В сочетании эти механизмы позволяют выживать организмам в биопленке в присутствии высоких концентраций антибиотиков.
В частности, важны три механизма антибиотикорезистентности бактерий в биопленках:
1. Устойчивость на поверхности биопленки: этот механизм возникает на поверхностных уровнях биопленки, когда антибиотик пытается проникнуть через клейкую, слизистую мембрану. Сложность структуры биопленки, состоящей из экзополисахарида, ДНК и белка, затрудняет прохождение антибиотиков через матрицу и достижение бактериальной мишени внутри. Кроме того, из-за замедленной диффузии антибиотика он, скорее всего, будет деактивирован на уровне поверхности быстрее, чем успеет распространиться. Однако это не является универсальной чертой всех биопленок, и пока неясно, насколько эффективно этот механизм стимулирует AMR.
2.Резистентность внутри микросреды биопленки: если антибиотику удается проникнуть через первый поверхностный слой биопленки, он сталкивается со сложной микросредой, которая возникает на более глубоких уровнях биопленки. На этом уровне скапливаются побочные продукты метаболизма, отходы и питательные вещества. Кроме того, количество кислорода может быть значительно снижено, что создает анаэробную среду. Сочетание этих факторов оказывает различное воздействие на антибиотики, зависящее от структуры и действия каждого антибиотика. Например, низкий уровень кислорода снижает бактерицидное действие антибиотиков тобрамицина и ципрофлоксацина, а изменение рН может негативно повлиять на действие аминогликозидов.
3.Резистентность бактериальных клеток-"персистеров": в глубине биопленки, где обитают бактерии, можно наблюдать еще больше способов, используемых для уклонения от антибиотикотерапии. В процессе выживания небольшие субпопуляции бактерий, избежавшие вторжения антибиотиков, могут перейти в "спороподобное" состояние, в котором они устойчивы к экстремальным условиям, таким как химическая обработка или действие антибиотиков. Эти клетки называют клетками-персистерами. Персистеры находятся в спящем состоянии и не делятся в присутствии антибиотиков. Важно отметить, что их выживание и резистентность к антибиотикам не связаны с какими-либо генетическими изменениями, и как только организмы освобождаются от биопленки или снова начинают делиться, они возвращаются к своему профилю чувствительности, существовавшему до персистирования.
Для бактерий одним из самых больших преимуществ биопленки является тесная близость множества организмов друг к другу. Это не только позволяет использовать такие стратегии коммуникации бактерий, как кворум сенсинг, но и способствует переносу мобильных генетических элементов. Фактически, среда биопленки поддерживает стабильность плазмид и позволяет организмам легче передавать информацию о резистентности. Что еще хуже, многие из переносимых бактериями элементов ДНК кодируют факторы, способствующие развитию биопленки, что еще больше способствует устойчивости биопленки и инфекции у пациента.
Диагностика и борьба с биопленками на медицинских устройствах
Хотя инфекции, вызванные биопленками, могут быть повторяющейся, опасной для жизни проблемой для пациентов, диагностика инфекций, вызванных биопленками на медицинских устройствах, может быть сложной для хирургов, врачей и других медицинских работников. Часто для этого необходимо взять образцы с поверхностей медицинских изделий, что может потребовать инвазивных процедур, таких как аспирация или удаление хирургическим путем медицинских приспособлений. Однако можно также использовать культуры крови, биологических жидкостей или других тканей, ассоциированных с инфекцией. За отбором проб следует получение стандартной микробиологической культуры для идентификации, а также тестирование на чувствительность к антибиотикам. Однако это часто бывает проблематично из-за прихотливых или необычных культур микроорганизмов. Наконец, биопленка может быть полимикробной. Смешанные культуры может быть трудно диагностировать, что затрудняет определение правильной схемы лечения антибиотиками, особенно если препарат направлен на доминирующий микроб, который растет быстрее, чем полимикробное сообщество.
Инфекции, связанные с устройствами, чаще всего вызываются Staphylococcus epidermidis и Staphylococcus aureus. Однако список микроорганизмов (особенно бактерий и грибков), которые могут прикрепляться к медицинским устройствам и вызывать инфекцию, длинный и разнообразный. Исследования показывают, что S. epidermidis составляет около 80% бактерий, вызывающих инфекции, связанные с медицинскими устройствами, в больничных условиях, но грамотрицательные бактерии с множественной лекарственной резистентностью, такие как Escherichia coli, Klebsiella pneumoniae, Acinetobacter baumannii и Pseudomonas aeruginosa, стали значительно чаще встречаться при катетер-ассоциированных инфекциях мочевыводящих путей. В последнее время грибки, такие как Candida auris, также стали опасными агентами, вызывающими образование биопленок. Наконец, проблема рецидивирующей инфекции часто может осложнить борьбу с биопленками на медицинских приспособлениях. Это связано с самой природой биопленок и трудностями полного искоренения инфекций, вызванных ими.
Современные методы профилактики (и, в некоторой степени, терапии) этих типов инфекций делятся на две широкие категории: поверхностное покрытие или элюирование и физические/механические/электрические/биологические методы. Например, модификация поверхности медицинских устройств с помощью антимикробных препаратов или антимикробных агентов (серебро) была в центре внимания многих исследований для уменьшения микробной колонизации и образования биопленок. А мощные спреи и аэрозоли использовались как физико-механические методы удаления биопленок (например, очистка хирургического участка, экссудатов или зубных биопленок).
Учитывая распространенность биопленок в госпитальных условиях и их способность создавать идеальную среду для обмена механизмами резистентности, необходимо повысить осведомленность об этих опасностях. По мере развития программ управления противомикробными препаратами и профилактики инфекций все более важным будет понимание опасности, которую представляют биопленки, и того, как предотвращение передачи и приобретения организмов, вызывающих биопленки, может непосредственно повлиять на распространение AMR.