Понимание того, как Cas9 влияет на внецелевые последовательности, может помочь исследователям усовершенствовать CRISPR-опосредованное редактирование генома.
В конце 2023 года FDA одобрило препарат Casgevy для лечения серповидно-клеточной анемии - это первое разрешение на терапию, в которой используется инструмент редактирования генома - кластеризованные регуляторные межпалиндромные повторы (CRISPR) для специфической инактивации гена человека в качестве лечения генетического заболевания. Хотя генная терапия на основе CRISPR потенциально может лечить несколько генетических заболеваний, опасения по поводу изменений в нецелевых участках задержали ее терапевтическое использование.
Дэвид Руэда, специализирующийся на биофизике одиночных молекул в Имперском колледже Лондона, изучает внецелевую активность CRISPR-ассоциированного белка (Cas) 9, одной из наиболее широко изученных CRISPR-нуклеаз. В недавнем исследовании, опубликованном в журнале Molecular Cell, он и его коллеги продемонстрировали, что отрицательно свернутые конформации ДНК усиливают внецелевое действие Cas9. Эти результаты подчеркивают важные аспекты будущих применений технологии редактирования генома.
В основе CRISPR лежат два основных компонента: направляющая РНК (gRNA) из 17-24 нуклеотидов, которая находит целевую последовательность, и нуклеаза Cas, которая делает разрез в этом точном месте. Обычно для того, чтобы Cas9 связала и расщепила целевую последовательность ДНК, необходимо наличие последовательности protospacer adjacent motif (PAM) непосредственно ниже цели; это обычно обеспечивает редактирование по мишени. Однако и в этом случае система не совершенна.
В предыдущем исследовании Руэда и его группа продемонстрировали, что растяжение ДНК увеличивает активность Cas9 вне мишени. Далее они решили проверить эти результаты в физиологическом контексте: им было интересно узнать, как отрицательная суперспираль, или скручивание ДНК, которое происходит во время нормальной транскрипции и репликации, влияет на активность CRISPR Cas9 вне мишени.
Для своих экспериментов группа использовала одномолекулярный оптический пинцет. "На самом деле он очень похож на тот, что можно увидеть в фильме "Звездный путь", - говорит Руэда. "Это настоящий притягивающий луч, который позволяет нам захватывать и манипулировать объектами в пространстве". Отрицательно свернув линейную нить ДНК, выделенную из бактериофага, ученые продемонстрировали, что такая конформация значительно увеличивает связывание Cas9 с нецелевыми участками. Мэтт Ньютон, соавтор исследования, был взволнован, увидев эти эффекты. "Мне захотелось узнать, изменит ли это что-нибудь, если вы будете воздействовать на настоящую геномную ДНК человека?" - поделился он.
Для анализа геномной ДНК человека исследователи выбрали метод скрининга in vitro - циркуляризацию с целью регистрации эффектов расщепления путем секвенирования (CIRCLE-seq). Исследователи фрагментировали и циркуляризировали ДНК из клеточной линии человека и обработали ее Cas9 и ДНК-гиразой, чтобы вызвать отрицательную суперспиральность in vitro. Активность Cas9 привела к распрямлению кольцевых фрагментов ДНК, и исследователи провели секвенирование линейных фрагментов, выявив последовательности, в которых фермент делал разрезы. Было показано, что обработка ДНК-гиразой более чем в два раза увеличивает количество сайтов расщепления вне мишени.
Следующим шагом было подтверждение результатов на человеческих клетках. Клетки обработали Cas9 и использовали метод INDUCE-seq, позволяющий выборочно секвенировать фрагменты с двухцепочечными разрывами ДНК - отличительной чертой расщепления Cas9. Когда исследователи сравнили последовательности off-target из INDUCE-seq с последовательностями из экспериментов CIRCLE-seq, они обнаружили менее чем 25% совпадение между результатами. Эти данные позволили предположить дополнительные эффекты, связанные с изменением структуры ДНК другими клеточными способами, например транскрипцией. Проверив свою гипотезу, исследователи обнаружили, что более 70% сайтов, не являющихся мишенями, совпадают с областями с высокой транскрипционной активностью.
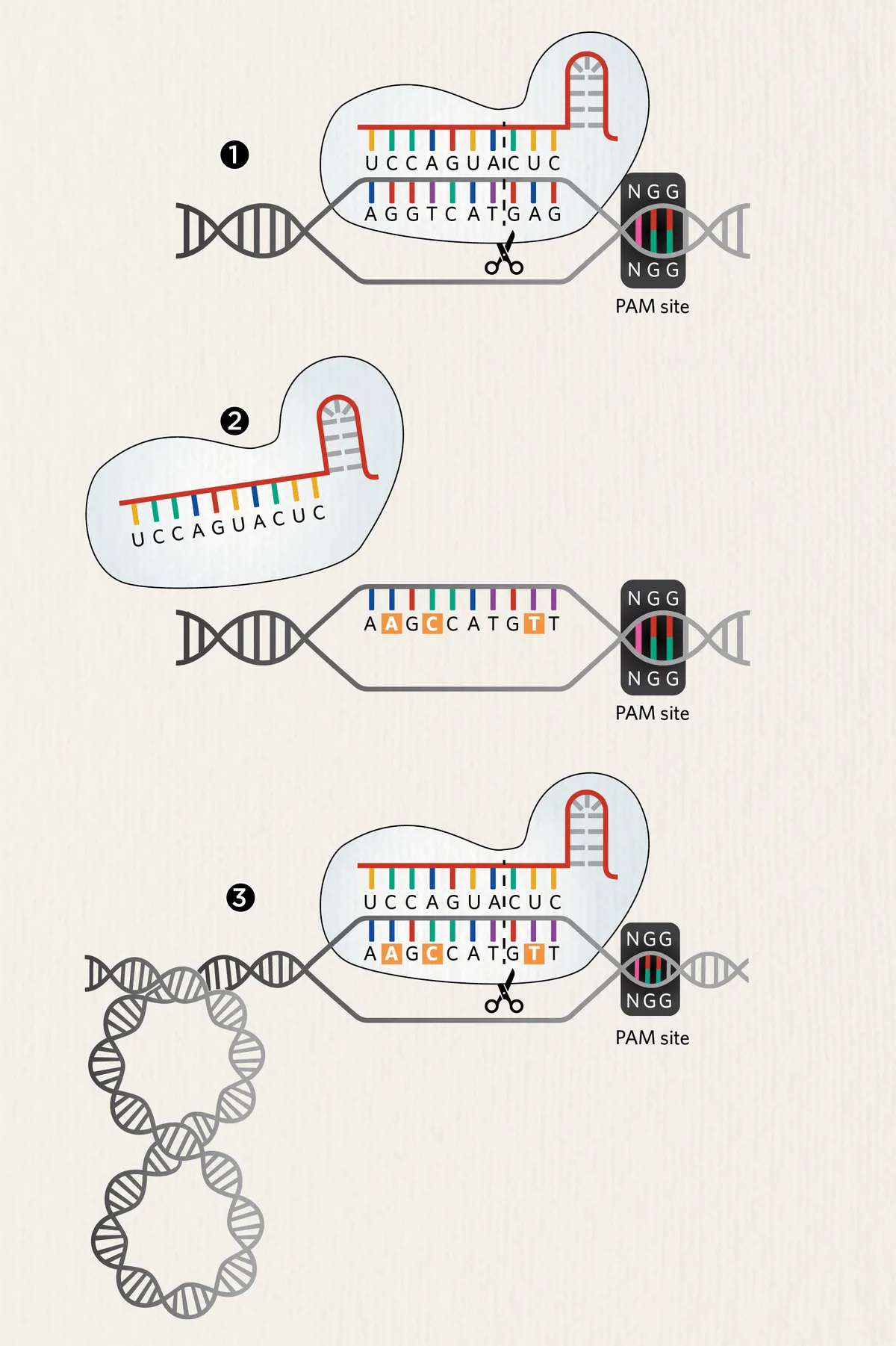
CRISPR-Cas9 должна нацеливаться на определенные последовательности в геноме, но из-за конформации ДНК она может не попасть в цель.
© ISTOCK, WRAGG
"Влияние сверхсвертывания ДНК на геномную активность Cas9 относительно интересно и ново", - считает Шендар Цай, молекулярный генетик из Детской исследовательской больницы Святого Иуды, который не участвовал в исследовании, но имеет патенты на разработку технологий секвенирования генома, включая CIRCLE-seq. Он заинтересован в проведении дополнительных исследований, изучающих распространенность этих внецелевых участков в клетках и их последствия с помощью более глубокого профилирования. "Понимание геномной активности редакторов - очень важный вопрос, особенно для терапевтического применения", - говорит Цай.
"Мы хотим знать, что эти редакторы на самом деле делают в геномах живых клеток".
"Эти результаты могут предоставить дополнительный механизм, с помощью которого в клетках появляются внецелевые разрезы, и, возможно, помогут нам разработать новые системы CRISPR-Cas, которые будут более точными", - уверен Руэда.