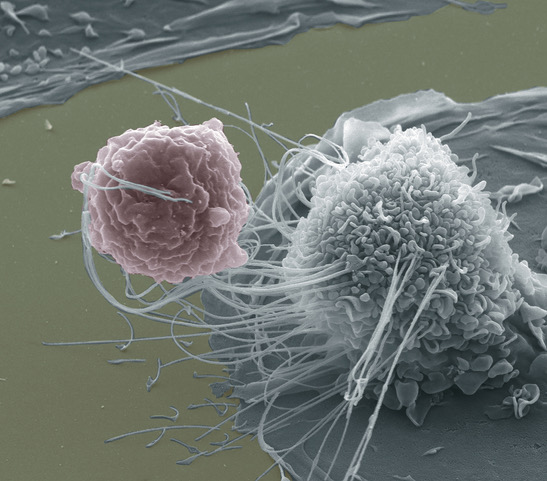
Инфекции с множественной лекарственной резистентностью (MDR) Escherichia coli представляют собой значительную угрозу для здоровья населения во всем мире и имеют разрушительные последствия для здоровья пациентов.
Грамотрицательные инфекции с MDR создают риск неэффективности существующих методов лечения антибиотиками из-за наличия у бактерий двух мембран (внутренней и внешней) и выработки бактериями β-лактамаз. К сожалению, период разработки новых антибиотиков составляет 6-10 лет, в то время как бактерии могут эволюционировать и выдерживать концентрации антибиотиков в 1000 раз большие, чем их предки дикого типа, менее чем за 2 недели в лабораторных условиях. Что еще более важно, в недавнем исследовании сообщалось, что MDR E. coli проявляет резистентность и к антибиотику последнего резерва - колистину. К 2050 году из-за отсутствия эффективных антибиотиков будут погибать десять миллионов человек в год. Таким образом, назрела необходимость разработки альтернативной стратегии эффективного и безопасного лечения MDR E. coli.
В попытке решить эту проблему было использовано множество стратегий, таких как фотовозбуждаемые квантовые точки, наночастицы (НЧ) на основе пробиотиков и микроволново-резонансные НЧ. Эти антибактериальные стратегии в основном связаны с генерацией тепла, реактивных форм кислорода (ROS) или антимикробных пептидов. Однако до их клинического применения еще далеко. Идеальной стратегией было бы использование уже одобренных технологий для избирательного уничтожения патогенов, оставляя при этом нормальные клетки неповрежденными.
Макрофаги (MΦ), являясь одной из важнейших клеток врожденного иммунитета, играют важную роль в предотвращении микробной инвазии за счет ROS, образующейся в результате биокаталитического процесса. Важно отметить, что благодаря рецепторам на клеточной мембране MΦ очищают только патогены или апоптотические клетки и не атакуют нормальные клетки. Учитывая их избирательность по отношению к нормальным клеткам и патогенам, МΦ обладают потенциалом для безопасного лечения инфекций, вызванных MDR E. coli. Однако их физиологические концентрации H2O2 (50-100 мкмоль∙L-1) слишком малы для проявления антибактериальной активности.
К счастью, МΦ могут быть запрограммированы внешними стимулами благодаря своему пластичному фенотипу. Патогены и НЧ (например, НЧ оксида железа, НЧ CuS и Fe3O4@C/MnO2-PGEA (PGEA - сокращение от этаноламин-функционализированного поли(глицидилметакрилата) могут стимулировать МΦ к выработке Н2О2. Среди них ферумокситол и другие НЧ оксида железа, одобренные FDA. Поли(молочно-гликолевая кислота) (PLGA) также одобрена FDA. Кроме того, НЧ оксида железа обладают двойной ферментоподобной активностью как in vitro, так и in vivo, поскольку в кислой среде они могут реагировать с H2O2 с образованием высокотоксичных ROS - гидроксильных радикалов (-OH). Бактериальное инфекционное микроокружение имеет низкий (т.е. кислый) pH. Таким образом, нагруженные макрофагами частицы Fe3O4@PLGA (MΦ-Fe3O4@PLGA) обладают поведением интеллектуального катализатора, который может осуществлять реакцию Фентона для уничтожения патогенов, не причиняя вреда нормальным клеткам.
В данном исследовании мы представляем интеллектуальные каталитические частицы, которые контролируемо уничтожают MDR E. coli, не нанося вреда нормальным клеткам, путем интеграции интеллектуального центра управления с катализатором реакции Фентона. Эта платформа использует преимущества частиц MΦ-Fe3O4@PLGA для производства H2O2 и липидных капель (ЛК) под воздействием MDR E. coli. Эти процессы запускают пути энергетического метаболизма, биосинтеза и метаболизма гликанов, а также липидного обмена. Кроме того, образующийся H2O2 вступает в реакцию с НЧ Fe3O4 с образованием высокотоксичного -OH. Кроме того, ЛК содержат множество антипатогенных белков, способных воздействовать на MDR E. coli. Антибактериальная эффективность частиц MΦ-Fe3O4@PLGA в отношении MDR E. coli составила 99,29% ± 0,31% in vitro. Частицы MΦ-Fe3O4@PLGA также активируются in vivo и демонстрируют отличный эффект при лечении перитонита in vivo.
Таким образом, в данной работе была представлена информация о разработке частиц MΦ-Fe3O4@PLGA в качестве биомиметических интеллектуальных катализаторов. Частицы MΦ-Fe3O4@PLGA продемонстрировали отличную антибактериальную способность за счет биокатализа и Фентон-катализа. Под воздействием MDR E. coli частицы поляризовались в фенотип M1. МΦ фенотипа М1 в результате биокатализа продуцировали Н2О2 и ЛК. Селективный фентоновский катализ происходил благодаря наличию Н2О2 в лизосоме и инфекционном микроокружении. ЛК нацеливались на E. coli и участвовали в антибактериальном процессе.
Более того, жизнеспособность, целостность и функционирование клеток сохранялись после нескольких пассажей. Наночастицы PLGA и Fe3O4 одобрены для использования в организме человека Управлением по контролю за продуктами и лекарствами США. В целом частицы MΦ-Fe3O4@PLGA могут стать препаратом "off-label" для клинического применения. Биомиметический интеллектуальный катализ в полной мере использует свойства MΦ и Fe3O4@PLGA NPs для лечения инфекций и может быть распространен на другие клетки и НЧ для лечения заболеваний. Однако необходимость культивирования живых клеток ограничивает его клиническое применение.