Эксперименты показывают как легко организмы могут развить способность использовать солнечный свет для получения энергии.
Дрожжи - любители углеводов, они живут за счет ферментации сахаров и крахмала из таких источников, как тесто, виноград и зерно, а в качестве побочных продуктов производят хлеб, вино и пиво. И вот недавно исследователи сделали один из видов дрожжей менее зависимым от углеводов, позволив ему использовать свет в качестве энергии.
По словам Магдалены Роуз Осберн, геобиолога из Северо-Западного университета США, не принимавшей участия в исследовании, которое было опубликовано на прошлой неделе на сервере препринтов bioRxiv, оно является "первым шагом к более сложным способам создания искусственного фотосинтеза". Кроме того, этот метод повторяет ключевой эволюционный процесс - освоение энергии света. "Это необычно", - считает Фелипе Сантьяго-Тирадо, биолог из Университета Нотр-Дам. "В какой-то степени это похоже на превращение животного в растение".
Ну, не совсем. Для преобразования углекислого газа в сахара, которые служат топливом для жизни на Земле, растения используют белковый комплекс, включающий хлорофилл, для переноса электронов и протонов, которые осуществляют химические реакции и передают энергию. Исследователи уже много лет работают над воссозданием фотосинтеза, чтобы изучить возможности более эффективного использования света в качестве источника энергии для солнечных батарей и других применений, а также для селекции растений и других организмов с целью повышения их продуктивности.
Но для того, чтобы хлорофилл выполнял свою работу, необходимо множество других молекул. Поэтому Энтони Бурнетти, генетик из Технологического института Джорджии, и биолог-эволюционист Уильям Рэтклифф из Georgia Tech искали более простое решение. Они остановились на белке родопсине, который не требует большого молекулярного окружения. К такому же решению пришла и природа: бактерии, некоторые протисты, морские водоросли и даже вирусы водорослей используют родопсин для преобразования света в полезную энергию, зачастую для перекачки протонов для клеточных функций.
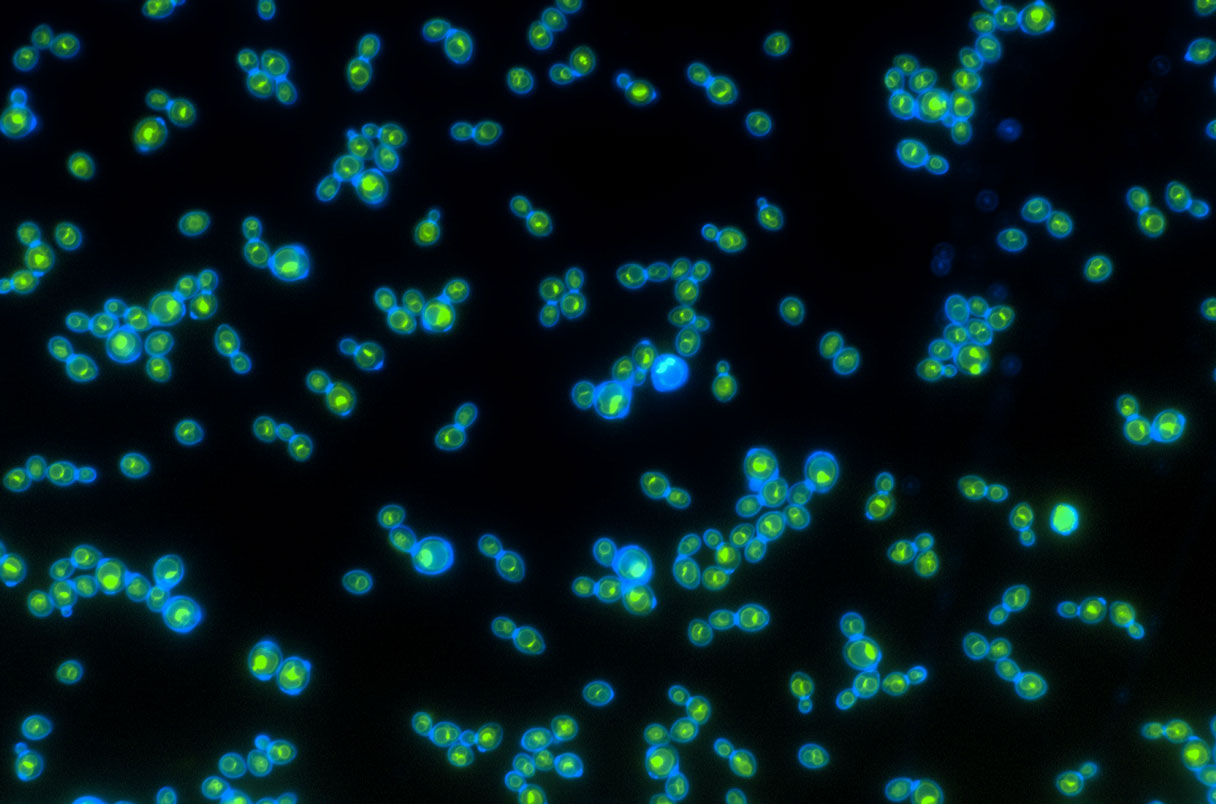
Исследователи начали с введения гена родопсина, принадлежащего морской бактерии, в пивные дрожжи (Saccharomyces cerevisiae). Бурнетти надеялся, что родопсин попадет в вакуоль дрожжей - наполненный ферментами мешочек, в котором происходит деградация ненужных белков. Молекулы АТФ подпитывают этот процесс, нагнетая протоны в вакуоль, чтобы сделать ее внутреннюю среду кислой - оптимальной для распада.
Бурнетти задался вопросом, может ли световая энергия выполнять эту работу. Но первая попытка исследователей дала осечку, когда родопсин, созданный геном, попал в другой отсек, предназначенный не для деградации, а для синтеза белка. Поэтому Бурнетти стал искать родопсин, о существовании которого в вакуолях уже было известно. Он остановился на одном из них - родопсине из кукурузной парши, грибкового патогена. Прикрепив к белку зеленую флуоресцентную метку, он и его коллеги убедились, что он локализовался в вакуолях дрожжей, как они и надеялись.
Ученые пошли дальше, чтобы доказать, что эти модифицированные дрожжи действительно используют свет. Они вырастили новый штамм в тех же условиях, что и оригинальные, неизмененные дрожжи, и облучили его зеленым светом, к которому родопсин наиболее чувствителен. Клетки светочувствительного штамма жили недолго, но размножались достаточно быстро, чтобы превзойти нечувствительные к свету дрожжи на 0,8%, обнаружили авторы исследования. Это "огромное преимущество", - говорит Сантьяго-Тирадо. Ожидается, что с течением времени клетки, использующие свет, в конечном итоге заменят неизмененные клетки так же, как ранние пользователи света могли заменить своих конкурентов в природе много веков назад.
Бурнетти и его коллеги считают, что свет побуждает родопсин перекачивать больше протонов в вакуоль, освобождая клетки от необходимости тратить АТФ на эту задачу и высвобождая эту энергию для роста клетки другими способами. Повышение кислотности внутри вакуоли может привести к тому, что ферменты за пределами вакуоли начнут работать быстрее и быстрее изнашиваться, что также может объяснить более высокий уровень гибели этих измененных клеток. Каким бы образом это ни происходило, "это явно идет на пользу дрожжевым клеткам", - говорит Майкл МакМюррей, молекулярный биолог из Университета Колорадо.
Но эксперимент может не раскрыть ничего нового о том, как использование родопсина развивалось в природе. "Я думаю, что авторы преувеличивают эволюционное значение своей работы", - считает Роберт Бланкеншип, биохимик из Вашингтонского университета. "Это искусственная конструкция и не является продуктом естественной эволюции".
Тем не менее, другие специалисты считают, что эта работа может найти применение в промышленности, медицине и фундаментальных исследованиях. Алааттин Кайя, биолог, изучающий старение в Университете Вирджинии, говорит, что эти дрожжевые клетки могут помочь прояснить, почему закисление вакуолей в течение жизни клетки иногда приводит к нарушению работы митохондрий и, в свою очередь, ускоряет старение. Он бы хотел добавить родопсин в сами митохондрии, чтобы проследить его воздействие.
Бурнетти тоже желает нацелиться на митохондрии, но по другой причине. "Несмотря на то, что в природе этого, кажется, никогда не было, мы планируем в конечном итоге ввести родопсин в митохондрии". Поскольку митохондрии могут эффективно производить АТФ, добавление родопсина могло бы обеспечить большое количество энергии непосредственно от Солнца, подобно тому, как это делает фотосинтез. В этом отношении дрожжи станут немного больше похожи на растения.