Исследователи открыли новый принцип разработки вакцин: их эффективность зависит не только от компонентов, но и от структуры вакцины.
Подтвердив эту концепцию в ходе многочисленных исследований, ученые Северо-Западного университета США разработали терапевтические противораковые вакцины для борьбы с одной из самых сложных на сегодняшний день мишеней — опухолями, вызываемыми вирусами папилломы человека (ВПЧ). В новом исследовании, опубликованном в журнале Science Advances, ученые обнаружили, что систематическое изменение ориентации и размещения одного пептида, нацеленного на борьбу с раком, может привести к созданию препаратов, которые повышают способность иммунной системы атаковать опухоли.
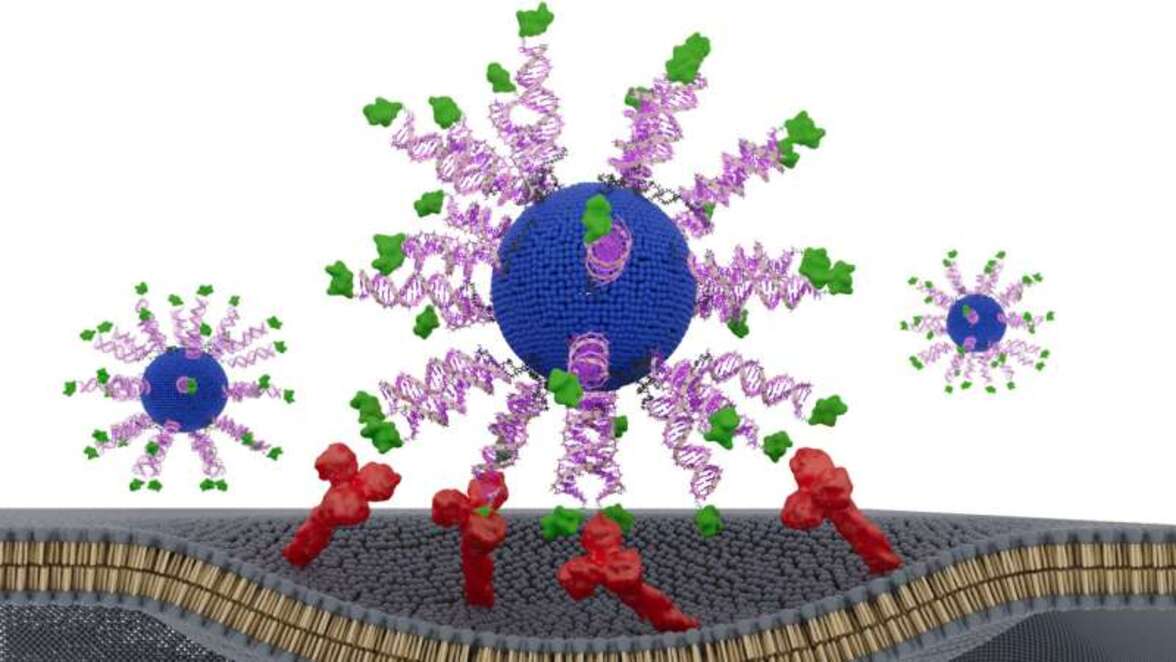
Сначала исследователи разработали вакцину в виде сферической нуклеиновой кислоты (SNA) — глобулярной формы ДНК, которая естественным образом проникает в иммунные клетки и стимулирует их — и намеренно перестроили компоненты SNA различными способами. Затем они протестировали каждую версию на гуманизированных животных моделях ВПЧ-позитивного рака и на образцах опухолей головы и шеи, полученных от пациентов.
Один из вариантов вакцины неизменно превосходил другие — уменьшал количество опухолей, увеличивал выживаемость животных и генерировал большее количество высокоактивных противораковых Т-клеток. Результаты показывают, как незначительное изменение в расположении компонентов может повлиять на то, насколько терапевтическая нановакцина активирует иммунную систему и вызывает чрезвычайно мощный, разрушающий опухоль ответ.
Идея о том, что структура играет ключевую роль в эффективности вакцин, лежит в основе развивающейся области "структурной наномедицины", термин, предложенный пионером наномедицины Чадом А. Миркиным. "В больших и сложных лекарственных препаратах есть тысячи переменных, которые определяют их эффективность", - сказал Миркин, возглавлявший исследование. "Потенциал структурной наномедицины заключается в том, чтобы из множества возможных конфигураций определить те, которые обеспечивают наибольшую эффективность и наименьшую токсичность".
В традиционных подходах к разработке вакцин исследователи в основном полагаются на комбинирование ключевых компонентов. Например, типичные методы иммунотерапии рака состоят из молекулы или молекул опухолевых клеток (антигенов) в сочетании с адъювантом, который стимулирует иммунную систему. Антиген и адъювант смешивают в коктейль и затем вводят пациенту. Миркин называет это "блендерным подходом", при котором компоненты полностью не структурированы. "Если вы посмотрите на то, как развивались лекарства за последние несколько десятилетий, то увидите, что мы перешли от четко определенных небольших молекул к более сложным, но менее структурированным лекарствам", - поясняет Миркин. "Вакцины против COVID-19 — прекрасный пример: нет двух одинаковых частиц. Несмотря на то, что это очень впечатляет и чрезвычайно полезно, мы можем добиться большего и для создания наиболее эффективных противораковых вакцин нам придется это сделать".
Миркин обнаружил, что структурный подход наномедицины может быть использован для целенаправленной организации антигенов и адъювантов в оптимальные конфигурации. При соответствующей структуре те же компоненты проявляют повышенную эффективность и сниженную токсичность по сравнению с неструктурированными вариантами. Миркин и его коллеги уже применили подход структурной наномедицины для разработки вакцин SNA против нескольких различных видов рака, включая меланому, тройной негативный рак молочной железы, рак толстой кишки и рак предстательной железы. Все они показали себя многообещающими в доклинических моделях и семь препаратов SNA уже прошли клинические испытания на людях для лечения целого ряда заболеваний. SNA также входят в состав более 1000 коммерческих препаратов.
В новом исследовании Миркин и коллеги обратилась к раку, вызываемому ВПЧ, который вызывает большинство видов рака шейки матки и быстро растущую долю случаев рака головы и шеи. Хотя существующие вакцины против ВПЧ могут предотвратить вирусную инфекцию, они не помогают пациентам бороться с раком после того, как он уже развился. Чтобы устранить этот пробел, ученые разработали несколько терапевтических вакцин, которые обучают самую мощную защиту иммунной системы — Т—клетки-"киллеры" CD8 - распознавать и уничтожать ВПЧ-позитивные раковые клетки. Каждая частица вакцины содержит наноразмерное липидное ядро, иммуноактивирующую ДНК и короткий фрагмент белка ВПЧ, уже присутствующего в опухолевых клетках.
Все версии вакцины содержали одни и те же ингредиенты. Единственным отличием было расположение и ориентация пептидного фрагмента или антигена, полученного из вируса папилломы человека. Ученые протестировали три конструкции: одну, в которой фрагмент, нацеленный на борьбу с раком, был спрятан внутри наночастицы, и две, в которых он был прикреплен к поверхности частицы. В поверхностных конструкциях фрагмент был прикреплен с помощью разных концов, известных как N—конец и С—конец, - незначительное изменение ориентации, которое может повлиять на то, как иммунные клетки обрабатывают его.
По сравнению с другими вариантами вакцины, которая содержала антиген на поверхности частицы, фрагмент прикрепленный к N—концу, вызывал гораздо более сильную иммунную атаку. Т-клетки-киллеры вырабатывали в восемь раз больше гамма-интерферона, ключевого противоопухолевого сигнала. Эти Т-клетки были гораздо эффективнее в уничтожении ВПЧ-позитивных раковых клеток. В гуманизированных мышиных моделях ВПЧ-позитивного рака рост опухоли значительно замедлился. В образцах опухолей, взятых у пациентов с ВПЧ-позитивным раком, вакцина убивала в два-три раза больше раковых клеток. "Этот эффект был достигнут не за счет добавления новых ингредиентов или увеличения дозы", - рассказал Миркин. "Это произошло благодаря более рациональному использованию одних и тех же компонентов. Иммунная система чувствительна к геометрии молекул. Оптимизация способа присоединения антигена к SNA позволяет иммунным клеткам обрабатывать его более эффективно".
Заглядывая в будущее, Миркин хочет вернуться к предыдущим вакцинам, которые изначально казались многообещающими, но не вызывали достаточно сильного иммунного ответа у пациентов. Демонстрируя, что наноразмерная архитектура повышает иммунитет, работа Миркина дает представление о разработке более эффективных терапевтических вакцин против многих видов рака на основе известных компонентов, ускоряя разработку методов лечения при одновременном снижении их стоимости. Миркин также предполагает, что искусственный интеллект будет играть решающую роль в разработке вакцин в будущем. Алгоритмы машинного обучения могут быстро перебирать практически бесконечные комбинации компонентов, чтобы точно определить наиболее эффективные структуры.
"Этот подход может изменить разработку вакцин", - считает Миркин. "Возможно, мы отказались от вполне приемлемых компонентов вакцин просто потому, что они были в неправильной конфигурации. Мы можем вернуться к ним, перестроить и превратить их в сильнодействующие препараты. Мы доказали, что структура имеет значение — всегда, без исключений".