В статье, опубликованной недавно в журнале Frontiers in Microbiology, ученые описали возможности использования везикул наружной мембраны, производимых грамотрицательными бактериями, в качестве вакцин и методы их более широкого применения.
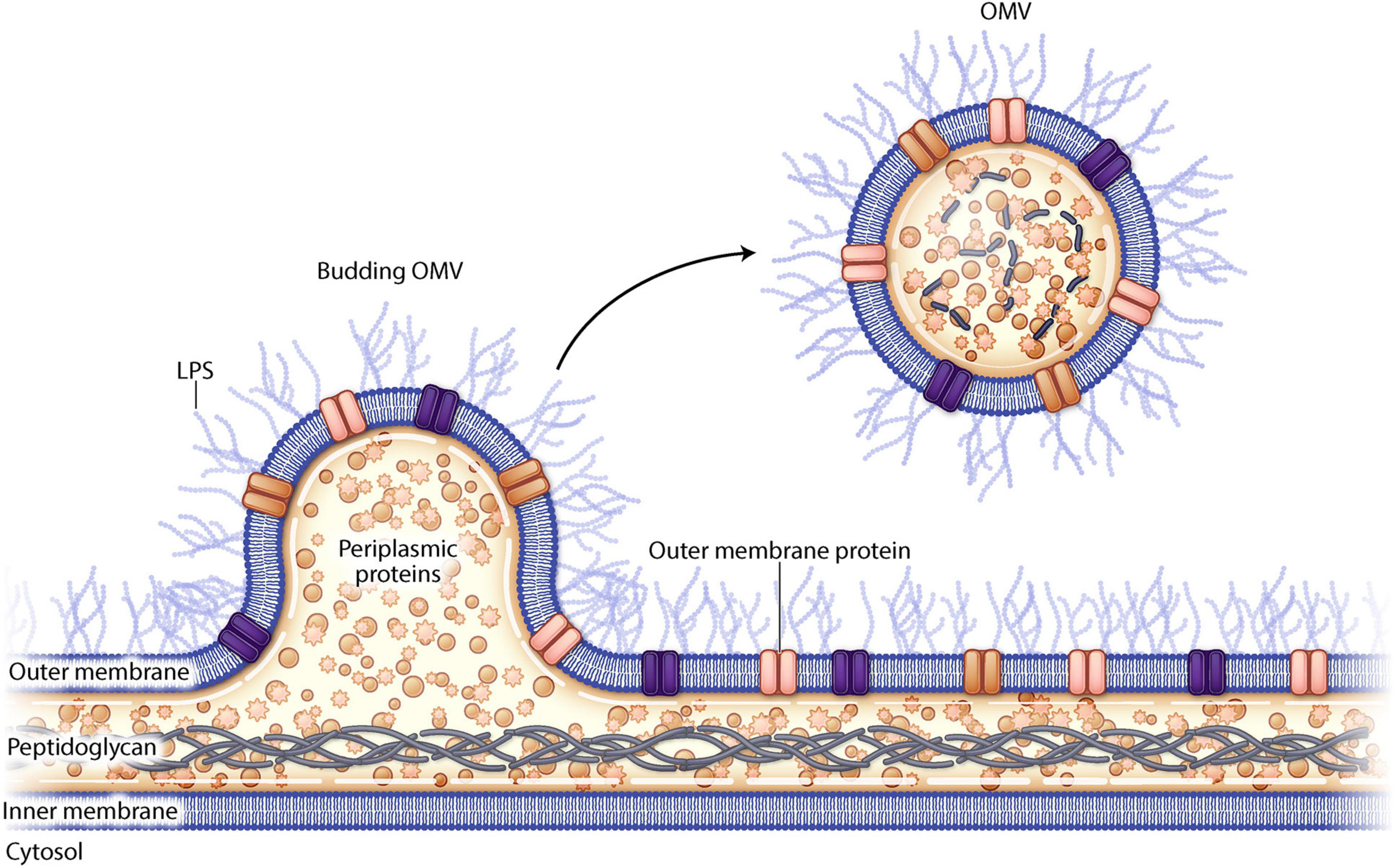
Везикулы внешней мембраны (ВВМ) представляют собой сферические липидные наночастицы диаметром 20-300 нм. Эти везикулы образуются из клеточной мембраны грамотрицательных бактерий и содержат бактериальные белки, липиды, нуклеиновые кислоты и другие компоненты. ВВМ патогенных или непатогенных бактерий играют важную роль в бактериальном патогенезе, межклеточной коммуникации, горизонтальном переносе генов, кворум сенсинге и поддержании жизнеспособности бактерий. Однако, будучи нерепликативным компонентом, ВВМ не могут самостоятельно индуцировать патогенез заболевания.
Бактериальные белки и гликаны делают ВВМ мощным иммуногенным компонентом, который может быть использован в качестве адъювантов для индуцирования иммунного ответа хозяина. Благодаря этому свойству ВВМ считаются потенциальными кандидатами для разработки вакцин. Грамотрицательные бактерии выделяют ВВМ во время роста или в стрессовых условиях. Однако такие спонтанные ВВМ выделяются в небольших количествах и поэтому не могут быть использованы для крупномасштабного производства вакцин.
Было разработано несколько стратегий для увеличения производства ВВМ. Соникация, вихревое перемешивание или экстракция с помощью ЭДТА были применены для механического разрушения бактериальной мембраны, что приводит к высвобождению ВВМ. ВВМ, выделенные с помощью ЭДТА, тесно связаны с нативной бактериальной мембраной и вызывают иммунные реакции. В отличие от этого, соникация и вихревое перемешивание увеличивают количество немембранных компонентов в конечном продукте, что приводит к повышению антигенности и снижению безопасности.
Экстракция с использованием детергентов - еще один хорошо задокументированный метод, позволяющий получать ВВМ с пониженным содержанием липополисахаридов (ЛПС), которые являются бактериальными токсинами. Несмотря на снижение риска токсичности, этот процесс приводит к потере многих бактериальных белков и липопротеинов, что в свою очередь приводит к подавлению ВВМ-стимулированных иммунных реакций.
Манипулирование определенными бактериальными генами может увеличить процесс везикуляции и, таким образом, привести к получению высокого уровня генетически модифицированных ВВМ. Гены, кодирующие бактериальные липопротеины Lpp и NlpI и белок внешней мембраны OmpA, являются основными мишенями для генетических манипуляций. Непатогенные штаммы бактерий могут экспрессировать гетерологичные белки для снижения токсичности и повышения иммуногенности ВВМ. Интересующий белок может быть слит с бактериальным трансмембранным белком, и полученная плазмида может быть введена в бактериальный штамм, который впоследствии продуцирует рекомбинантные ВВМ, экспрессирующие желаемый белок на поверхности.
Другой потенциальной стратегией экспрессии гетерологичных белков является гликоинженерия О-антигена ЛПС. Гликозилированные ВВМ могут быть получены путем экспрессии генов О-антигена патогена в непатогенном мутантном штамме бактерий с О-антигеном. Патоген-ассоциированные молекулярные паттерны, находящиеся на внешней мембране ВВМ, активируют рецепторы распознавания образов на клетках хозяина, что приводит к активации врожденной иммунной сигнализации и высвобождению провоспалительных цитокинов. Захват ВВМ клетками врожденного иммунитета вызывает адаптивный иммунный ответ.
ЛПС действует как адъювант, вызывая эффективный иммунный ответ хозяина на бактериальный антиген, экспрессированный на поверхности ВВМ. Однако чрезмерная экспрессия ЛПС может привести к гиперстимуляции иммунных реакций и индукции системного токсического шока. Для снижения уровня высокореактивного ЛПС на поверхности ВВМ можно использовать препараты на основе детергентов или генетические манипуляции.
ВВМ, экспрессирующие желаемые антигены, могут вводиться в организм различными путями, включая пероральный/интраназальный, внутримышечный, подкожный, внутрибрюшинный и внутрикожный. Недавно было показано, что ВВМ, экспрессирующий белок спайка SARS-CoV-2, вызывает стойкий иммунный ответ у хомяков при интраназальном введении.
В настоящее время доступны две клинически одобренные ВВМ-вакцины, VA-MENGOC-BC™ и Bexsero™, против инвазивного штамма N. meningitidis серогруппы B. Белок PorA, экспрессируемый этой бактерией, сильно варьируется между штаммами. ВВМ, полученные из штамма, вызывающего менингит, были успешно использованы для разработки вакцин против этого конкретного штамма бактерий. Также разрабатывается множество вакцин на основе ВВМ. Эти вакцины разработаны для борьбы с N. gonorrhoeae, Shigella spp., Salmonella spp., внекишечной патогенной E. coli (EXPEC), V. cholerae, M. tuberculosis и нетипируемой H. influenzae.
Помимо антибактериальных вакцин, ВВМ использовались для производства вакцин против вирусов, включая вирус гриппа и коронавирус. ВВМ, нацеленные на опухоли и содержащие терапевтические siRNA или опухолевые антигены, также были разработаны в качестве терапевтических вакцин против рака.