Шесть лет назад Майкл Нидервейс впервые описал туберкулезный некротизирующий токсин (ТНТ).
Этот токсин стал основателем нового класса ранее не известных токсинов, присутствующих у более чем 600 видов бактерий и грибов. Токсин высвобождается Mycobacterium tuberculosis внутри макрофагов человека и разрушает их.
Исследователи Университета Алабамы описывают, как два небольших белка ESX, производимые M. tuberculosis посредничают в секреции ТНТ путем образования пор в мембранах бактериальных клеток. Это открытие может иметь широкое применение, потому что отличительный мотив из трех аминокислот - триптофан/любая аминокислота/глицин или сокращенно WXG найден в EsxE и EsxF, во многих других малых белках микобактерий и в большом суперсемействе бактериальных белков, схожих с EsxE и EsxF.
"Мы впервые показали, что небольшие белки Esx семейства WXG100 обладают важной молекулярной функцией внутри клетки Mtb, опосредуя секрецию токсинов", - говорит Нидервайс. "Наши результаты свидетельствуют о динамическом механизме образования пор малыми белками Esx, который может быть применим и к другим членам большого семейства белков WXG100. Таким образом, наше исследование не только представляет собой значительное продвижение в понимании секреции ТНТ и, вероятно, других белков M. tuberculosis, но и описывает биологическую функцию Esx-паралогов у M. tuberculosis и их гомологов в большом семействе белков WXG100 у грамположительных бактерий".
ТНТ является одним из двух доменов в белке наружной мембраны M. tuberculosis CpnT; активность домена ТНТ CpnT в цитозоле макрофага вызывает гибель макрофага путем гидролиза NAD+. M. tuberculosis имеет внутреннюю мембрану и внешнюю мембрану и белок должен пройти через каждую, чтобы выделиться из бактерии вовне. Как CpnT попадает на внешнюю мембрану было неизвестно. EsxE и EsxF являются частью того же сегмента гена, что и CpnT и исследователи предположили, что два небольших белка могут быть вовлечены в секрецию токсина.
Создавая различные штаммы с дефицитом EsxE и EsxF, они показали, что оба белка необходимы для транслокации CpnT на клеточную поверхность M. tuberculosis и для секреции ТНТ в цитозоль макрофагов, инфицированных M. tuberculosis. Кроме того было обнаружено, что EsxE и EsxF являются поверхностными, мембранно-ассоциированными белками M. tuberculosis.
Чтобы узнать больше о механизме этой транслокации, ученые сделали мутанты каждого Esx белка, где аминокислота триптофан единичного мотива WXG в каждом белке была заменена аминокислотой аланином. Мутанты показали, что неповрежденный мотив WXG в EsxE и EsxF был необходим для эффективной транслокации CpnT на внешнюю мембрану M. tuberculosis и последующей секреции TНT в цитозоль инфицированных макрофагов. Пурификация водорастворимых белков EsxE и EsxF показала, что они образуют димеры EsxE-EsxF и пять из этих димеров собраны в звездоподобные структуры, как это было видно при электронной микроскопии. Каждый из них имел диаметр около 10 нанометров, а центральная пора - 3 нанометра.
Эксперименты с плоскими двухслойными липидами были ключевыми для понимания молекулярной функции EsxE-EsxF, так как они показали, что поры EsxE-EsxF образуют каналы через липидные мембраны. Также исследователи показали, что мотивы WXG необходимы для формирования пор и разрушения мембран комплексом EsxE-EsxF, а мотивы - для опосредованной сборки функциональных олигомеров EsxE-EsxF.
Это проясняет биохимическую роль ранее загадочного мотива WXG, который по сути является молекулярным переключателем, управляющим образованием пор.
"EsxE и EsxF представляют собой первые известные компоненты внешних мембран, опосредующие секрецию белка у M. tuberculosis", - отметил Нидервайс. "Тем не менее, маловероятно, что EsxE и EsxF являются достаточными для секреции ТНТ, так как во всех известных системах секреции бактериальных белков требуется источник энергии. Поэтому вполне возможно, что EsxE-EsxF ассоциирован с другими белками или белковыми комплексами для достижения экспорта CpnT и секреции ТНТ".
Исследователи предлагают две модели транспортировки CpnT белками EsxE и EsxF. В первой, гетеродимеры EsxE-EsxF образуют поры во внутренней мембране, а затем формируют еще одну пору во внешней мембране для создания трансмембранных каналов для экспорта токсина . "Либо, - говорит Нидервайс, - внутренний мембранный канал расширяется, чтобы охватить периплазму посредством образования филаментов, и соединяется с порами EsxE-EsxF во внешней мембране. В этой модели предполагаемый канал EsxE-EsxF позволяет экспортировать полипептид CpnT на внешнюю мембрану M. tuberculosis и последующую секрецию ТНТ и EsxE-EsxF".
Статья Нидервайса "Порообразующие белки Esx опосредуют секрецию токсинов Mycobacterium tuberculosis" опубликована в Nature Communications.
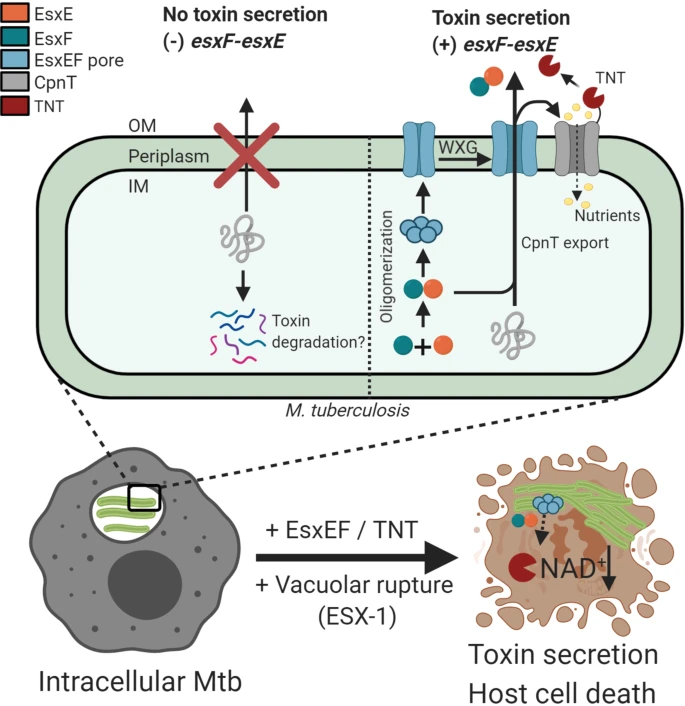
При внутриклеточной инфекции макрофагов Mtb вырабатывает наружный мембранный белок CpnT, который обеспечивает поглощение питательных веществ и чей секретируемый С-концевой TНT домен является основным токсином Mtb. ТНТ токсичен только тогда, когда получает доступ к цитозолю макрофагов после разрыва фагосомальной мембраны. Гетеродимеры EsxE-EsxF образуют крупные олигомерные комплексы, которые связываются с мембранами клеток и образуют на их поверхности поры. Этот процесс необходим для экспорта CpnT на клеточную поверхность Mtb. Затем EsxEF и CpnT/TНT совместно секретируются и высвобождаются в цитозоль макрофага, что приводит к гибели клетки. При отсутствии EsxEF, CpnT не локализуется и, возможно, деградирует в цитозоле Mtb, что предотвращает самоинтоксикацию.